
Autoria: Alberto Federman Neto, AFNTECH.
Revisto e Ampliado em 7 de Outubro de 2023.
1. INTRODUÇÃO:
Neste Artigo, A História, e revisando a Química, dos precipitantes e dos contra-íons usados para isolar cátions inorgânicos, organometálicos e certos cátions orgânicos.
Também alguns experimentos simples usando precipitantes. Veja a Parte 2, desta série.
A imagem que ilustra este artigo. Uma recristalização de ácido pícrico, 2,4,6-trinitrofenol. Fonte da Imagem: NeonPulse, Sciencemadness (2016).
Nesta primeira parte, uma História dos precipitantes, e uma revisão sobre a síntese (preparação) do ácido pícrico e dos picratos e compostos relacionados,e alguns experimentos com picratos.
2. HISTÓRIA DOS CONTRA-ÍONS E DOS PRECIPITANTES.
O Médico e Alquimista Persa Abū Bakr Muhammad Zakariyyā Rāzī , Razés, teria estudado a precipitação de enxofre e de alguns metais. AMR, S.S.; TBAKHI, Ann. Saudi Med. 27, 325 (2007).
Também o Alquimista Alemão/Holandês Johann Rudolf Glauber, descobridor da neutralização ácido-base e do sulfato de sódio, ao extrair e purificar vários metais, inclusive ouro, a partir de minerais, usou precipitantes, principalmente fosfatos:
WERTHEMANN, R. “Johann Rudolph Glauber. und die Veredelung
der Metalle.” Tradução Livre do Título: “Johann Rudolf Glauber, e o Refino dos Metais.” 188 (2009?) . GLAUBER, J.R. (Autor), JANSSONIUM, J. (Editor), “Operis Mineralis.“,”Tradução Automática e Livre do Título: “O Trabalho com os Minerais.” Amsterdã, Holanda, Parte 1 (1651).
Também o Médico e Alquimista Alemão Andreas Cassius estudou os cloretos de ouro e o ácido cloroáurico (obtido por dissolução do ouro em água régia), e com eles obteve a “Púrpura de Cassius“, que é ouro coloidal, hoje seriam chamadas “nanopartículas”.
A Obra da “Púrpura de Cassius” foi escrita e publicada pelo filho de Andreas Cassius: CASSIUS, A.; WOLFFI, G. (Editor) “De Extremo Illo et Perfectissimo Naturae Opificio ac Principe Terrae Norun Sidere Auro.” Tradução Automática do Título: “Da Última e Mais Perfeita Obra da Natureza, e do Príncipe da Terra, Norun, a Estrela Dourada ” , Hamburgo, Alemanha (1685).
Mas há estudos Históricos que mostraram que Glauber é que foi o verdadeiro descobridor do ouro coloidal, ouro potável; 25 anos antes de Cassius. Veja: GLAUBER, J.R “Tractatus de Medicina Universali. Sive Auro Potabili Vero.” Tradução Livre do Título: “Tratado de Medicina Universal. Ou Ouro Potável Verdadeiro.” Editora Joannem Janssonium, Amsterdã, Holanda (1658).
O Médico e Alquimista Alemão Georg Ernst Stahl, um experimentalista brilhante, propagador da Hipótese do Flogisto, a primeira Teoria ponderal “Não Alquímica” o que o tornaria um dos primeiros Químicos e um dos mais influentes de sua época. Aliás, deve-se a Stahl o uso da palavra “Química” pela primeira vez ( e não mais “Alquimia”).
Ele conhecia a dissolução do ouro por água régia e a formação dos ácidos cloroáuricos e dos cloauratos precipitantes. STAHL, G.E.; SHAW, P. (Tradutor), OSBORN, J.; LONGMAN, T. (Editores) “Philosophical Principles of Universal Chemistry.” Londres, Inglaterra, Págs.: 105, 115, 282, 302-305, 378 (1730).
Em 1828, o Químico Sueco Jons Jacob Berzelius havia descoberto os cloroplatinatos. BERZELIUS, J.J. Pogg. Ann. Phys. 89, 435 (1828).
O Físico e Químico Prussiano Heinrich Gustav Magnus estudou os complexos de platina com amônia, e usou tetracloroplatinato, PtCl4 —, como precipitante. [Pt(NH3)4][PtCl4] “Sal Verde de Magnus“. KAUFFMANN, G.B. Plat. Met. Rev. 20, 21 (1976). MAGNUS, G. Pogg. Ann. Phys. 90, 239 (1828).
As reações do metal platina com água régia e/ou halogênios, formando os cloroplatinatos (Berzelius, 1828) foram estudadas sistemáticamente no século XIX, pelo Químico Irlandês Robert Kane e pelo Químico Alemão-Suiço Christian Friedrich Schönbein. KANE, R. Dublin J. Med. Chem. Scienc. 5, 1 (1834). KANE, R.J. Dublin J. Med. Chem. 1, 304 (1832). SCHONBEIN, C.F. Mem. Proc. Chem. Soc. 3, 17 (1845). SCHONBEIN, C.F. Lond. Edin. Dub. Phil. Mag. J. Scienc. 29, 40 (1846).
Alcalóides e compostos precipitáveis eram isolados como cloroplatinatos ou cloroauratos. SCHULZE, H. Am. J. Pham. 347 (1849). BLYTH, J. Quart. J. Chem Soc. London 1, 345 (1849). PERRINS, J.D., Am. J. Farm. 456 (1863).
Quando os compostos de ouro eram usados, tanto fazia usar cloreto de ouro (III), AuCl3, como sais de ácido cloroáurico. Já no período da Química Contemporânea, o Químico Dinamarquês Niels Janniksen Bjerrum demonstrou que nas soluções dos cloretos de ouro, sempre existia o ânion complexo tetracloroaurato, AuCl4- . BJERRUM, N. Bull. Soc. Chim. Belg. 57, 432 (1948).
Em 1846, O Famoso Químico Alemão Barão Justus Von Liebig analisava os compostos de platina e empregou cloroplatinato para isolar a Quinina. BROCK, W.H. Plat. Met. Rev. 17, 102 (1973). VON LIEBIG, B.J. Am. J. Pharm. 12, 181 (1846).
Nesses trabalhos, Liebig e o Químico Escocês Thomas Graham, usaram cloroplatinatos para isolar um complexo de cloreto de acetila e alguns outros compostos. GRAHAM, H. (Autor), BRIDGES, R. (Revisor), “Elements of Chemistry.” Editora Lea & Blanchard, Philadelphia, EUA, Págs.: 538-542 (1843)
O tetracloroplatinato, PtCl4 — já estava se tornando um dos principais contra-íons, precipitantes, de escolha, e usados para isolar muitos compostos químicos. CAHOURS, M.A. Lond. Dub. Mag. J. Scienc. 34, 476 (1849). CHANCEL, G. Am. J. Scienc. 9, 275 (1850). BOOTH, J.C.; BOYÈ, M.H. Trans. Am. Phil. Soc. 9, 185 (1845). BAUDRIMONT, A. “Traité de Chemie Générale et Experimentale, Avec les Applications.”, Editora J.B. Baillière, Paris, França, Vol. 2,. Pág. 813 (1846).
Também foram usados hexacloroplatinatos… DITTMAR, W. ARTHUR, J.M., Scienc. Trans. Roy. Soc. Edin. 33, 561 (1888). E tetracloroauratos … DUNSTAN, W.R. ; SHEPHEARD, W.F.J. J. Chem. Soc. Trans. 63, 195 (1893). Mas a platina e o ouro são metais muito raros e caros. Por isso, outras alternativas mais baratas foram buscadas.
O Farmacêutico e Químico Estoniano-Alemão Johann Georg Noel Dragendorff desenvolveu seu original e famoso “Reagente de Dragendorff“, DRAGENDORFF, G. Zeit. An. Chem. 5, 406 (1866).
Outras Referências: DRAGENDORFF, G.; BOTTCHER, K. (Editor) “Beitrage zur Gerichtelichen Chemie Einzelner Organischer Gifte: Untersuchunger dem Pharmaceutischen Institut in Dorpat.” Tradução Automática do Título: “Contribuições Para a Química Forense dos Venenos Orgânicos. Investigações do Instituto Farmacêutico de Dorpat.” São Petersburgo, Rússia, Págs.: 134 e 142 (1872) . RAAL, A. Et Al. Pharmazie, 75, 299 (2020).
O reagente é uma solução de tetraiodobismutato de potássio, KBiI4, ânion tetraiodobismutato, e foi muito usado para isolar alcalóides. DRAGENDORFF, G.; GREENISH, H.G. Tradutor), “Plant Analysis, Qualitative and Quantitative.”Editora J.H. Vail & Co., New York, EUA (1888).
O reagente era preparado, na formulação original, com iodeto de bismuto. BiI3 mas hoje é mais fácil preparar empregando carbonato de bismuto Bi2(CO3)3 ou subnitrato de bismuto (nitrato básico de bismuto). Links 1. 52, 53, 54, 55. RAAL, A. Et Al. Pharmazie, 75, 299 (2020).
Mas existem várias modificações do reagente de Dragendorff: SVENDSEN, A.B.; VEERPORTE, R. “Chromatography od Alkaloids.” Editora Elsevier, Amsterdã, Holanda. J. Chromat. Lib. 23A, Part A, Págs.: 11, 12, 14, 62, 83, 92, 94, 102, 116, 115, 123, 228, 236, 478, etc… (2011).
Muitos outros contra-íons e precipitantes inorgânicos e complexos foram e ainda são ocasionalmente usados: tetraiodomercuratos, fosfomolibdatos e fosfotungstatos, reineckatos, triiodetos, halocadmatos etc… KUMAR, S. Asian J. Pharm. Scienc. Technol. 4, 107 (2014). ALESSANDRI, P.E. “Metodo Sistematico oer L’Analisi Chimica Qualitativa Delle Sostanze Inorganiche e Organiche e per le Richerche Tossicologiche.” Tradução Livre do Título: “Método Sistemático Para a Análise Química Qualitativa das Substâncias Inorgânicas e Orgânicas, e para as Pesquisas Toxicológicas.” Editora Ulrico Hoepli, Milão, Itália (1886).
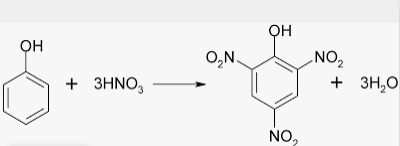
3. CONTRA-ÍONS E PRECIPITANTES ORGÂNICOS, ÁCIDO PÍCRICO.
Químicamente, é o 2,4,6-trinitrofenol. Artigo geral: SRIVASTAVA, K.K. Et Al. Der Pharma Chemica, 9, 64 (2017).

História do Ácido Pícrico:
O composto na época “Corpo“, foi obtido por Glauber, Loc. Cit, , por tratamento da lã com ácido nítrico. Há muitas referências de que foi em 1742! . Apenas alguns exemplos… links 2, 3, 4, 5, 6, 7 , 8. WIKIWAND, “Picric Acid.”.
Mas isso não é possível, em 1742 não pode ser, pois…. Glauber já estava morto! Faleceu em 1670…. garimpando a informação, achei!
O assunto é citado na tradução para o Inglês das Obras de Glauber, recoletadas, traduzidas e republicadas em 1689.. GLAUBER, J.R.; PACKE, C. (Tradutor); MILBOUM, T.; NEWMAN, D. (Coletores e Editores), “The Works of the Highly Experienced Chemist. Johann Rudolf Glauber.” Londres, Inglaterra, Pág 87 (1689):
Citação:
“That the Coals of the Wool, with the help of the Nitre^ have rob’d the Sol of its colour, thou art not al together out of the way, nor wholly in the right. If tbou fay’fr, that there is no Mineral Virtue in the Wool, but that the Sol became white by the addition of Mercury^ thou art not wholly out of the way neither j but this is not to be underftoodof the Common Affair)”
Tradução Livre, Inglês Arcaico:
“Que os carvões da Lã, com a ajuda do nitro, lhe roubaram a cor do Sol, tu não estás totalmente fora do caminho, nem totalmente certo. Se você sabe que não há virtude mineral na lã, mas que o Sol tornou-se branco pela adição de mercúrio, você não está totalmente fora do caminho, mas isso não pode ser entendido como algo comum”
Em 1771, o Alquimista Irlandês Peter Woulfe preparou o ácido pícrico pela nitração do índigo, mas já o havia observado em 1767. WOULFE, P. Phil Trans, Roy. Soc, London 57, 517 (1767). WOULFE, P. Phil. Trans. Roy. Soc. London 61, 114 (1771). outro Link.
O nome “Ácido Pícrico” foi dado pelo Químico Francês Jean Baptiste Dumas , quando estudava os produtos preparados do ´índigo. DUMAS, J. Ann. Chim. Phys. 2, 204 (1841).
No mesmo ano, o Químico Francês Auguste Laurent determinou a estrutura do ácido pícrico e o reconheceu como um fenol, através de uma preparação inequívoca a partir dele. LAURENT, A. Ann. Chim. Phys. 3, 195 (1841).
Também foi Dumas, Loc. Cit. quem usou ácido pícrico como precipitante e fez os primeiros picratos. BIRD, J.C.; BAROL, A. J. Am. Pharm. Assoc. 23, 996 (1934).
Para fazer picratos, se faz reagir o ácido pícrico com carbonatos, bicarbonatos, hidróxidos , aminas ou sais diversos, óxidos básicos ou anfóteros.
Existem artigos clássicos (que todos nós, que usamos ácido pícrico, conhecemos), sobre a preparação em laboratório, de vários picratos de metais. SILBERRAD, O.; PHILIPS, H.A., J. Chem. Soc. Trans. 93, 474 (1908). MATSUKAWA, M. Et Al. Scienc. Tech. En. Mat. 64, 183 (2003). Também há úteis artigos mais recentes. SRINIVAS, D., Et Al. New J. Chem. 38, 3699 (2014).
Em que pese o fato de ainda, na época antiga, ser obtido do índigo, o ácido pícrico e seus sais, os picratos , sempre tiveram aplicações técnicas e científicas. COOLEY, A.J. “A Cyclopaedia od Several Thousand Practica Recyepts.” Editora D. Appleton & Co., Ney York, EUA, Págs. 162-165 (1846).
Seu uso para tratar queimaduras, que até hoje persiste (na Pomada de Picrato de Butesin), data de 1817. MORBUS, M.C., “Monografia. Memorandum Cholera, Looking Backwards.” Republicado em Indian Med. Gazette 63, 28 (1928).
O Químico e pioneiro da Fotografia Ótica e da Química Fotográfica, que estudou as propriedades dos sais de prata de aplicação fotográfica, o Americano Mathew Carey Lea popularizou o uso do ácido pícrico e dos picratos em Química.
LEA, M.C. Am. J. Scienc. 2 402 (1860). LEA, M.C. Am. J. Scienc. Arts 31, 402 (1860). LEA, M.C. Lond. Edin. Dub. Phil. Mag. 21, 477 (1861). LEA, M.C. Am. J. Scienc Arts, 32, 180 (1861).
O ácido pícrico e os picratos sempre chamaram a atenção dos químicos, por formarem precipitados e cristais esplêndidos, de fácil obtenção e preparo…

Em um exemplo moderno, ácido pícrico forma sais com muitas aminas. Exemplo com ortofenatrolina: SRIVASTAVA, K.K. Et Al. Pelagia Res. Lib. D. Chem. Sin. 6 , 7 (2015). Também forma sais com metais e com organometálicos catiônicos. Eu fiz muitas dessas reações, desde meu curso técnico, até depois do Doutorado!
Link público para baixar a Tese: FEDERMAN NETO, A. (Autor); MILLER,J. (Orientador); BONILHA, J.B.S.; MARCONDES, M.E.R.; OLIVATO, P.R.; VICHI, E.J.S. (Examinadores) “Síntese e Reatividade de Complexos de Ferro com Ligantes Homocíclicos de Caráter Aromático.” Tese de Doutorado em Ciências, Modalidade: Química Orgânica, Especialidade: Química Organometálica. Universidade de São Paulo, Instituto de Química, Depto. de Química Fundamental (1986).
Também forma complexos de transferência de carga sólidos e isoláveis. Exemplo, o picrato de uréia. NASEEMA, K.; RAO, V. Et Al. Opt. Las. Technol. 43, 1286 (2011). E o picrato do naftaleno. CHANDRAMOHAN, A. Et Al. Spectrochim. Acta A. Mol. Biomol. Spec. 71, 755 (2008). Também as amidas podem complexar com o ácido pícrico. PANDIAN, R. Acta Cryst. E66, o1820 (2010).
Imidazóis (e cátion imidazólio) também formam sais e ao mesmo tempo, complexos de transferência de carga. MORENO-FUQUEN, R.; SANTOS, R.A.; AGUIRRE, R. Acta Cryst. 67, o139 (2011). Esses picratos imidazol-imidazólio híbridos foram estudados muito recentemente: AROKIA-DOSS, M.; SIVAKUMAR, K.; RAJARAJAN, G.; THANIKACHALAM, V.; SELVANAYAGAM, S. J. Mol. Struct. 1276, 134726 (2023). Os pirazóis também formam picratos híbridos, salinos e com transferência de carga. ABISHA, W.; DHAS, D.A,. BALACHANDRAM, S.. JOE, I.H. Polycyc. Arom. Comp. 1 (2022).
Vemos então, que pela diversidade de derivados que podem se formar, o ácido pícrico se aproxima do precipitante ideal, de escolha, quando possível.
Até hoje, o picrato é o precipitante, contra-íon, orgânico mais utilizado. Exemplos de uso: RAMASAMY, G. Et Al. Optik 125, 4422 (2014). ; GOEL, N.; SINGH, U.P.; SINGH, G.; SRIVASTAVA, P. J. Mol. Struct. 1036, 427 (2013). Agradecimento a Pratibra Srivastava, pelo envio do artigo.
Referência relativamente nova, revisão completa e moderna da Química do ácido pícrico. SRIVASTAVA, K.K.; SRIVASTAVA, S.; ALAM, T.; RITURAJ, Der Pharm. Chem. 9 , 64 (2017).
Métodos de Síntese do Ácido Pícrico:
Você pode comprar, ou achar em algum colégio ou faculdade, uma amostra de ácido pícrico. Não é incomum. Também pode comprar a solução aquosa pronta.
Se o frasco for antigo, molhe o frasco antes de abrir, abra com cuidado, molhe ou cubra o ácido pícrico com água desionizada. Pode usar a solução sobrenadante, direto como precipitante.
Normas internacionais recomendam que ácido pícrico seja sempre armazenado úmido. READ, R. Chem. Aust. 20, (2014). Veja: “Picric Acid Safety”,em uwm.edu
Se desejar prepará-lo, é bem fácil.
O ácido pícrico tem uma cor bonita, amarela, e é um corante. Por essa razão, e por ser fácil de obter e cristalizar bem, sua síntese é prática bem comum de Química Orgânica em muitos livros texto.
Os métodos muito antigos, que partem do índigo, são todos caros e muito obsoletos. Não são mais usados.
A nitração no geral, do benzeno com ácido nítrico, foi descoberta pelo Químico Alemão Elhardt Mitscherlich, biografia em Inglês, em 1834. MITSCHERLICH, E. Ann. Pharm. 12, 305 (1834). Vela esta excelente revisão sobre a Nitração.
Métodos relativamente antigos e modernos, se baseiam na nitração da aspirina, do ácido salicílico e principalmente do fenol, muito mas baratos que o Índigo. Eventualmente, se pode nitrar o 2,4-dinitrofenol, préviamente obtido.
Nitração do fenol, métodos antigos: NIETZKI, R.; COLLIN, A.; RICHARDSON, W. (Tradutores), “Chemistry of the Organic Dystuffs.” Editora Gurney & Jackson, Londres, Inglaterra, Págs.: 24 e 273 (1892). DUSSAUCE, H.; BAIRD, H.C. (Tradutor e Editor) “Treatise of the Coloring Matters Derived From Coaltar.” Gráfica Collins, Philadelphia, EUA e Londres, Inglaterra, Pág 99 (1863).
O fenol, antigamente chamado “ácido fênico” ou “ácido carbólico” foi descoberto no alcatrão da hulha, pelo Químico Alemão Friedlieb Ferdinand Runge . Tratando o fenol com ácido nítrico, Runge observou a formação do ácido pícrico. RUNGE, F.F. Pogg. Ann. 31, 65 e 513 (1834). RUNGE, F.F. Pogg. Ann. 32, 308 e 328 (1834).
Que como vimos, já era conhecido. Laurent, Loc. Cit. identificou que o composto era o ácido pícrico, análogo ao preparado do índigo… PARTINGTON, J.R. “A History of Chemistry.” Editora Palgrave, Londres, Inglaterra, Vol. 4, Cap. XII, Pág. 376 (1964).
A síntese industrial do ácido pícrico, foi estudada, para fazer explosivos, pelo Químico Francês François Eugéne Turpin,TURPIN, F.E. “Comment on a Vendu la Mélinite.” Gráfica Imprimerie Lelong, Braine Le Comte, Bélgica (1892).
Preparação do Ácido Pícrico em Laboratório:
Links com detalhes para obtenção a partir da aspirina: 9, 10, 11, 12, 13, 14, 15, 16, 17. 44, 45. 48.
Links para obter ácido pícrico por nitração de ácido salicílico: 18, 19, 20, ou do 2,4 dinitrofenol.
Links para obter ácido pícrico a partir do fenol: Em solução água/dimetilsulfóxido; KHABAROV, W.G. Et Al. Org. Prep. Proc. Int. 49, 178 (2017). Nitração do fenol com mistura sulfonítrica: 31, 32, 33, 34. 48, 49, 50. 51.
A partir do fenol, através de sulfonação com ácido sulfúrico e depois nitrar com ácido nítrico. É o método de laboratório mais usado. 36, 37, 38, 39, 40, 41, 42, 43, 46, E muito desenvolvido para a indústria também. OLSEN, F.; GOLDSTEIN, J.C. Ind. Eng. Chem. 16, 66 (1924). KING, R. J. Chem. Soc. Trans. 119, 2105 (1921). SALEEM, F. Et Al. Int. J. Innov. Scienc. Technol. 62 (2019) .
Procedimento de Laboratório que eu uso para Fazer o Ácido Pícrico.
Ele pode ser comprado, mas é reagente controlado. Links: 21, 22, 23, 24. Você também pode comprar já em solução saturada aquosa. 25, 26, 27, 28, 29, 30.
Em todo o caso, é muito fácil faze-lo! Siga o descrito abaixo, ou prepare por um dos métodos que cito acima, ou nos links.
O ácido pícrico foi o primeiro composto orgânico que preparei, eu tinha apenas 12 anos. Eu e meu pai fizemos…. Ele era Patologista e o ácido pícrico é usado em uma solução para fixar peças histológicas, chamada líquido de Bouin, inventada pelo Médico Francês André Pol Bouin. BOUIN, P. Arch. Anat. Microsc. 1, 225 (1897).
Depois, fiz muitas outras vezes o ácido pícrico, como prática de Química Orgânica no curso técnico de nível médio e também na faculdade. E até na minha Tese de Doutorado, porque usei ácido pícrico. e ainda uso! FEDERMAN NETO, A.; MILLER, J. An. Acad. Bras. Ciênc. 54, 332 (1982).
Até hoje uso ácido pícrico em pesquisa. Como vimos, prefiro preparar a partir do fenol. Sugiro o método descrito abaixo, onde excesso de ácido sulfúrico é usado para garantir a trissulfonação inicial.
Meu método é uma modificação do protocolo amplamente descrito no clássico chamado “Livro do Vogel”, amplamente usado em aulas de Química Orgânica Experimental. VOGEL, A.I.; FURNISS, B.S.; HANNAFORD, A.J.; SMITH, P.W.G.; TATCHEL, A.R (Revisores), “Vogel’s Textbook of Practical Organic Chemistry.” Editora Longman Group, Essex, Inglaterra, 5a Ed., Pág 976 (1989). Outra Edição: VOGEL, A.I. “A Textbook of Practical Organic Chemistry.” Editora Longman Group, Londres, Inglaterra, 3a Ed., Pág. 678 (1959) Reimpressão de (1974).
Use luvas nitrílicas. Usar um balão de fundo chato, grande (2 ou 3 litros) e em vidro borosilicato, refratário. boca estreita. A mistura vai extravazar, se você usar vidraria pequena.
Colocar no balão 40 g. de fenol. O fenol industrial, escuro e até liquefeito, é satisfatório (usei muitas vezes, fenol industrial marca BHerzog).
Adicionar ao balão, aos poucos, grande excesso (90-100 g) de ácido sulfúrico concentrado. Agitar manualmente para dissolver. A mistura se aquece expontaneamente. Depois da adição, aquecer o balão, aberto, a 80-90 ºC, em placa elétrica, e manter esse aquecimento por 1 hora ou 1,5 horas.
Forma-se uma mistura amarelada de ácidos fenolsulfônicos, onde (em nosso protocolo) predominam os ácido dissulfonado e trisulfonado. Interromper o aquecimento, esperar esfriar e resfriar o balão em banho de gelo.
Quando frio, gelado, levar o balão para uma capela de exaustão, ou para um ambiente aberto, como o quintal. Adicionar rapidamente, em uma única porção, 160 ml de ácido nítrico. Agitar levemente por alguns segundos.
Rapidamente, colocar o balão sobre uma tela de amianto, e soltar o balão, não fique segurando. Afaste do balão.
Em poucos segundos ocorre uma reação espontânea e vigorosa. A mistura ferve e formam-se grandes quantidades de vapores nitrosos alaranjados. Resta um líquido amarelo.
Aquecer o balão na chapa elétrica, por 2 horas, com agitação ocasional. Verter a mistura sobre cerca de 600-700 g de gelo. Agitar com bagueta de vidro, esperar o gelo derreter, filtrar os cristais amarelos, por papel, ou a vácuo. Lavar bem com água gelada, para tirar os ácidos. Secar ao ar. Não secar completamente (***).
O ácido pícrico é obtido como cristais amarelos, com rendimento (observado por mim em muitas preparações) entre 60 e 85 %, calculado sobre fenol.
Pode ser purificado por recristalização de água, formando belíssimos cristais, mas o volume necessário de água é muito grande.
Ou recristalize de álcool-água 1:2. Na foto, cristais de ácido pícrico em álcool-água 1:2. FEDERMAN NETO, A. (2O22).

Outros solventes para a recristalização. Página 334, neste link. Recristalizar de ácido acético ou de benzeno. BENEDICT, S.R., J. Biol. Chem. 54, 239 (1922). BENEDICT, S.R. J. Biol. Chem. 82, 1 (1929).
Reações que ocorrem durante a preparação do ácido pícrico, pelo método que uso, sulfonação e nitração do fenol:

Outro protocolo bom para a preparação de ácido pícrico, também por nitração do fenol. Usamos outras vezes, como prática de Química Orgânica. MANO, E.B.; SEABRA, “Práticas de Química Orgânica.“, Editora Edgar Blucher Ltda., São Paulo, S.P. 3a Ed. Pág. 22 (1987), Reimpressão (2015).
(***) Agora vem o principal problema do ácido pícrico e principalmente, dos picratos. Eles são explosivos potenciais. SRINIVAS, D.; GHULE, V.D.; MURALIDHARAM, K. New J. Chem. 38, 3699 (2014). Outro Link.
Estoque o ácido pícrico sempre umidecido com 30-50% de água. De preferência em frascos de plástico. Evite os frascos esmerilhados. São explosivos, quando secos, principalmente os picratos de potássio, amônio, cobalto, outro link, níquel. E especialmente, o picrato de chumbo (II). é instável e perigoso.
Os picratos bem solúveis, ou que tem água de cristalização, como os de ferro (II), de sódio , prata , cobre e o de lítio, são menos perigosos. Em todo o caso, evitar secá-los.
Na foto abaixo, meu estoque de ácido pícrico. Reembalei em frascos de plástico, vantajosos em certos casos (veja estes meus artigos 1 e 2) e, umidecido com 30-40 % de água. No frasco da esquerda, produto comercial, ácido pícrico puro, marca Baker Analysed, EUA, similar a este frasco, e reembalado e úmido.
No pote laranja, largo, da direita, ácido pícrico bruto, preparado pelos alunos da Faculdade de CIências Farmacêuticas de Ribeirão Preto, Universidade de São Paulo, no curso de Farmácia, disciplina de Química Orgânica Experimental, em 2015. Eu recristalizo de água-álcool 2:1, antes de usar.

Ácido pícrico, Preparo das soluções precipitantes:
Solução saturada em água. Pese cerca de 1,5-2 g. de ácido pícrico e suspenda em 100 ml de água desionisada. Aqueça até ferver, com agitação ocasional, e deixe esfriar ate a TA. Estoque em um frasco fechado, junto com os cristais.
Solução Hidroalcóolica. (FEDERMAN NETO, 2012). Dissolver cerca de 7 g. de ácido pícrico, em 100 ml de álcool etílico 96 G.L. Diluir a mistura com 5 ml de água.
Essas soluções são precipitantes, contraíons, para isolamento dos picratos insolúveis ou pouco solúveis.
Experimentos. Picratos, Formação:
Para mostrar a formação de picratos, fiz experimentos simples. Preparei soluções concentradas extemporâneas de sais de metais, em geral cloretos, ao menos que indicado (para Tálio (I) usei sulfato Tl2SO4).
Nos tubos de ensaio, adicionei solução saturada de ácido pícrico. Observe.

Da esquerda para a Direita, seis tubos de ensaio…. Picrato de amônio, de potássio, picrato de cálcio, picrato de rubídio, de césio, picrato de tálio (I). Em geral, pouco solúveis.
Em experimentos similares, notei que picratos de sódio, de lítio, de bário, de zinco, cobalto, níquel e até de chumbo (esperado insolúvel) [usando nitrato, Pb(NO3)2], são mais solúveis e não precipitaram diretamente.
Assim, mostra-se que ácido pícrico é útil como precipitante e/ou contraíon.
Contudo, certas bases orgânicas não formam picratos iônicos, e sim por transferência de carga ou associados por pontes de hidrogênio. Nem sempre precipitam, a não ser em soluções concentradas ou neutralizadas.
É o caso, por exemplo, do picrato de uréia e do picrato de guanidina. ONGLEY, P.A. Nature 159, 812 (1947). SMOLKA, A. Monatsh. Chem. 6, 915 (1885). FAINER, P.; MYERS, J.L. An. Chem. 24, 515 (1952). WATT, G.W.; McBRIDE, W.R. J. Am. Chem. Soc. 77, 2751 (1955). VOZÁRIK, A. Angew. Chem. 15, 670 (1902).
4. CONTRA-ÍONS E PRECIPITANTES ORGÂNICOS, ÁCIDOS ESTIFÍNICO E PiCRÂMICO.
Relacionado ao ácido pícrico, é o ácido estifínico, trinitroresorcinol. A Química dele, do ácido pícrico e no geral, dos compostos aromáticos polinitrados, está revisada no excelente artigo de : SRINIVAS, D.. Loc. (2014).

Descoberto em 1866, pelo Químico Escocês John Stenhouse nos produtos do tratamento de resinas ou gomas vegetais com ácido nítrico. STENHOUSE, J. J. Chem. Soc. 19, 236 (1866). Ibid. 20, 433 (1867).
Hoje se sabe, mais fácil preparar por nitração do resorcinol, do diacetato do resorcinol, ou por nitrosação do resorcinol com nitrito e oxidação do produto nitrosado. A nitração também pode ser feita via sulfonação, como o ácido pícrico, ou diretamente com nitrato de sódio ou potássio e ácido sulfúrico.
SALTER, D.A,; SIMKINS, R.J. (1969) SMITH, R.J.; ROSS, D.S.; HARDEE, J.R.; WOLFE, J.F. J. Org. Chem. 53, 5568 (1988) . KAMETANI, T.; OGASAWARA, K. Chem. Pharm. Bull. Japan, 15, 893 (1967). SRINIVAS, D. Et Al. New J. Chem. 38 , 3699 (2014). Link para o trabalho completo. PAYNE, J.F. ; “Thermochemical Investigations of Nitroresorcinols and Relevant Metal Salts.” Tese Apresentada para Obtenção de Grau de Doutor em Filosofia. Bourne Laboratory, Dept. odf Chemistry, Royal Holloway College, Surrey, Inglaterra, Págs 28, 54, 58 etc… (1986 ). PREPCHEM, “Styphnic Acid” (2022). 56, 57, 58, 59, 60, 61,
Preparado por nitração de resorcinol em solução acética: HUALYN NORMAL UNIVERSITY, Patente Chinesa, CN101462963A (2008-20012). Patente Chinesa CN101462963B (2008-2012)
Em meu laboratório, preparamos uma amostra de ácido estifínico em 2018. [FEDERMAN NETO, A.; BORGES, A.D.L. (2018)]
Como prática de Química orgânica. Método de Johny (2004) e AlChemistery (2018). Outro bom protocolo para preparar o composto: HICKINBOTTON, W.J. “Reactions of Organic Compounds.” Editora Longmans Green & Co., Londres, Inglaterra, Pág. 94 (1936).
Recristalizei agora, em 2022, de água . P.F. 178,3 ºC. Medido com Aparelho de Ponto de Fusão de Capilar Marconi modelo MA-381.
Para comparar, dados de literatura ( ºC): 180 [PRISTERA, F. Et Al. An. Chem. 32, 495 (1960)] ; 176,5 e 176-179 [FINCH, A.; PANE, J. Thermochem. Acta. 170. 309 (1990)] ; 168-172 [ELDER, J.W.; MARIELLA, R.P. J. Chem. Eng. Data 9, 402 (1964)]. 179-180 [DrugFuture (2022)].
Experimento Simples. Formação de Estifanato de Ferricínio:
Em um tubo de ensaio, preparou-se uma solução aquosa de hidrogenosulfato de ferricínio, pelo procedimento descrito nesse artigo. Em outro tubo, ácido estifínico foi dissolvido em pouca água.
O conteúdo dos dois tubos foi misturado, e o liquido vertido em uma cápsula de porcelana branca, para melhor visualizar os cristais. E lentamente evaporado parcialmernte com calor suave, até 45 ºC.
Obtidos cristais verde azulados, muito escuros, mas brilhantes e muito refringentes, de Estifanato de Ferricínio. Relativamente solúveis em água. FEDERMAN NETO, A. (2022).

Evitei secar, estifanatos são explosivos potenciais.
Estifanato de Ferrícinio é reportado, mas foi localizado apenas em uma patente, e não em um artigo. Shaanxi Normal University, Patente Chinesa, CN108329369B (2018-2020).
Os cristais formados se assemelham muito aos descritos para o picrato de ferricínio , veja meu artigo e link 52, e o picrato de biferroceno Fe(II)-Fe(III).
O experimento demonstra o possível uso do ácido estifínico como contraíon ou precipitante.
Identificação Química de Estifanato de Ferricínio.
Pode-se usar métodos triviais. Como em outros compostos de Ferro (III), pois ferricínio, depois de mineralizado, se transforma em sais de ferro (III), e como tal, pode ser identificado por reações clássicas com tiocianatos, ácido salicílico etc…
Mas ferricínio é reduzido a ferroceno, por redutores como pó de ferro, sulfitos, tiossulfatos, cloretos de estanho, zinco metal, estanho metálico etc…
Mas vamos usar uma reação mais específica, que só ferricínio dá.
Ainda na década de 50, o Quimico Soviético Alexander Nikolaevich Nesmeyanov observou que íons hidróxido, ou bases, “reduziam” ferricínio a ferroceno. NESMEYANOV. A.N. Proc. Roy. Soc. A 246, 1247 (1958). Isso foi confirmado por Clark, em 1960, durante seus estudos sobre a metalação do ferroceno. CLARK, F.S.; BENKESER, R.A (Orientador), “….The Metalation of Ferrocene….” Tese de Doutorado em Filosofia, Purdue University, Indiana, EUA (1960).
Essa reação, com comportamento surprendente, não usual, foi confirmada por mim, em minha Tese de Doutorado. Durante anos, o mecanismo dessa reação permaneceu obscuro… PRINS, R. Et Al. J, Organomet. Chem. 39, 335 (1972). ALY, M.M. Inorg. Nucl. Chem Lett. 9, 369 (1973).
Por outro lado sabe-se que íons hidróxido são nucleofilicos e podem, em certa circunstâncias se comportarem como redutores. SAWYER, D.T.; ROBERTS Jr., J.L. Acc. Chem. Res. 21, 469 (1988).
O mecanismo mais aceito nos dias atuais, HOLECEK, J.; HANDLIR, K.; KLIKORKA, J.; BANG, N.D. Collect. Czech. Chem. Comm. 44, 1379 (1979). O Ferricínio reage com hidróxido e forma radical hidroxil e ferroceno. KOCHETKOVA, N.S. Et Al. J. Organomet. Chem. 235, C21 (1982).
Também é conhecido que radicais hidroxil são relativamente estáveis e se formam de hidróxido e oxidantes (como o ferricínio), tais como cloro, ozônio, água oxigenada etc… BERTALOZZI, R.; PELEGRINI, R. Quím. Nova, 25, 477 (2002). ATTRI, P. Et Al. Nature Scient. Rep. 5, 332 (2015). E também conhecido que ferricínio estabiliza radicais. OSELLA, D. Et Al. Inorg. Chim. Acta 306, 42 (2000). TABBI, G. Et Al. J. Med. Chem. 45, 5786 (2002). ALY, Loc. Cit.
Outras rotas propostas para essa decomposição. Formaria ferroceno, óxido de ferro (III) e ciclopentadienil radical. KUMPAN, N. Et Al. Roy. Soc. Chem. Adv. 7, 5759 (2017). Ou Oxigênio pode estar envolvido. HURVOIS, J.P.; MOINET, C. J. Organomet. Chem. 690, 1829 (2005). JURKOWSKY, K.; BAUER, E.B. Synthesis 53, 207 (2021). HUANG, W.H.; JWO, J.J J. Chin. Chem. Soc. 38, 343 (1991).
Para o caso do nosso teste. Em um tubo de ensaio, dissolver um pouco de estifanato de ferricínio em ácido sulfúrico diluído. Alcalinizar com hidróxido de sódio. Observe a “redução” e a formação de ferroceno, que precipita, e deixa uma solução amarela de estifanato de sódio.
C5H5-Fe-C5H5 = Ferroceno = Fc
Estif-+H = Àcido Estifínico, trinitroresorcinol
(C5H5)-Fe+-(C5H5) -Estif + NaOH = (C5H5)-Fe-(C5H5) + . OH + Na+-Estif
Obtem-se uma suspensão marrom esverdeada, onde se pode ver os cristais do ferroceno. deixando o tubo em repouso, com agitação ocasional, o ferroceno se decompõe (devido à ação redutora do ciclopentadieneto de sódio), formando hidróxidos ferroso e férrico e ferro metálico.
Ácido Picrâmico:
Apenas citando, por ele ser bem menos usado como precipitante. Ácido Picrâmico, 2-amino-4,6-dinitrofenol.
Ele foi descoberto pelo Químico Francês Alfred Claude Aimé Girard e pelo Alemão Friedrich Wohler. LEA, M.C. Am. J. Scienc. Arts 31, 188 (1861). RICHTER, C.A.; MITCHELL, J. J. Soc. Arts 15, 779 (1867).
Obtido pela redução parcial do ácido pícrico com sulfeto de sódio. Outro Link. É a Chamada Redução de Zinin. PORTER, H.K. Org. React. 20, 455 (2004). . HAMLIN, J.F.; McROBBIE, I.M. Speciality Chemicals. 371 (1991). PrepChem, (2022). Outro Link.
Do Matemático e Químico Russo (do Azerbaijão) Nikolay Nikolaevich Zinin . ZININ, N. Ann. Pharm. 31, 329 (1839). ZININ, N. Ann. Pharm. 34, 186 (1840). ZININ, N. J. Prakt. Chem. 27, 140 (1842).
Outros redutores podem ser usados: enzimas, sulfeto de ferro (II), açucar, proteinas, essências vegetais, glicose, outro link, gás sulfídrico , outro link, cianetos. STAS, M.J.S.; BAYER, A. (Editor) “Sur un Nouveau Derivé de L’Acide Picrique.” (1863). DE BRUYN, L.C. Rec. Trav. Chim Pays-Bas 2, 205 (1883).
Particularmente, eu gosto de fazer essa redução do ferricínio, com açúcar ou com glicose.



