
Autoria: Alberto Federman Neto, AFNTECH.
Revisto e Ampliado em 9 de Junho de 2020.
Neste Artigo, descrevo experimentos simples, que mostram as características não usuais da dissociação do ácido bórico, e sua capacidade de complexação.
RESUMO:
O ácido bórico é barato, pouco tóxico e facilmente manipulado nos laboratórios de Química. Mesmo que pequenos, ou amadores.
Além disso, tem três hidrogênios, em teoria, ionizáveis e pode atuar como ácido pŕótico clássico de Arrhenius, mas também como ácido de Lowry-Bronsted ou de Lewis. Isso o faz interessante como substrato para experimentos de Química.
Neste trabalho, foram desenvolvidos experimentos simples, que demonstram as características da dissociação e da complexação do ácido bórico. Em presença de certos açucares, como a frutose, ou polióis, como o manitol, as propriedades ácidas são aumentadas.
SUMMARY:
Boric acid is an inexpensive and low toxic, easily available chemical. It may be manipulated in any chemical laboratory, even in small or amateur labs.
It have in theory three ionizable hydrogens and may work as protic, Lowry-Bronsted or Lewis acid. This turns boric acid an interesting substrate for chemical experiments.
In this work, we develop simple experiments that show the caractheristics of the dissociation and complexation properties of boric acid. In presence of some sugars, as fructose, or polyols, as glycerol and manitol, the acidic properties of the boric acid are enhanced.
1. INTRODUÇÃO:
O ácido bórico (ácido ortobórico), é um composto barato e relativamente pouco tóxico, fácil de manipular, mesmo em laboratórios pequenos ou amadores. Só é perigoso se ingerido.
Por essas razões, e por ser um triácido fraco, com características de ionização e complexação sui generis, ele pode ser usado em alguns experimentos interessantes. Em Artigo anterior, descreví a História do ácido bórico, do bórax e do boro.
Interessante do ácido bórico é que ele tem apenas um hidrogênio prótico, e age ao mesmo tempo, como ácido clássico de Arrhenius, e/ou ácidos de Lowry-Bronsted e Lewis, como mostraremos nestes experimentos.
Sua fórmula molecular bruta é H3BO3, fórmula molecular plana é B-(OH)3, cuja estrutura tridimensional está na imagem que ilustra este Artigo. Link 21.
2. PREPARAÇÃO DAS SOLUÇÕES DE ÁCIDO BÓRICO:
Me baseei na solubilidade conhecida do ácido bórico. Links: 1, 2, 3, 4, 5. 12, BLASDALE, W.C.; SLANSKY, C.M. J. Am. Chem. Soc. 61, 917 (1939). 5,46 %, em água, a 25 oC.
Usei ácido bórico P.A, de marca ECIBRA. Alternativamente, produto de pureza farmacêutica, das marcas Henrifarma e Ely Martins.
Solução saturada:
Em um erlenmeyer, ou frasco com tampa, coloque ligeiro excesso (6,5-7,0 g.) de ácido bórico, adicione 100 ml de água desionizada. Agite fortemente. Ou deixe em repouso, com agitação forte ocasional, até que se dissolva o máximo possível do sólido.
Deixe chegar até a temperatura ambiente (a dissolução é endotérmica, a solução esfria espontaneamente) Decante ou filtre a solução. Será uma solução saturada de ácido bórico.
Você pode aproveitar essa solução saturada, para fazer uma prova de identificação. Esfrie um pouco dessa solução lentamente, ou coloque um pouco numa cápsula de porcelana e deixe evaporar lento. Os cristais são muito característicos. Bonitos, transparentes e em forma de escamas.

Eu acho mais fácil obter os cristais por esse método, mas se preferir, opere como descrito para protocolo de recristalização clássico, como nestes links: 127, 128. Livro, exemplar pertencente ao Autor do Blog: ARMAREGO, W.L.F.; PERRIN, D.D. “Purification of Laboratory Chemicals.” Editora Butterworth-Heinemann, Oxford, Inglaterra, 4a Ed., 3a reimp. (2000).
Solução 0,1 mol/Lt
Essa solução precisa ser preparada por um método um pouco modificado, porque a solubilização não é de tudo rápida e é endotérmica.
Coloque 3,091 g. (em balança analítica, 3,0915 g.) (0.05 mol) (mol é 61,831) de ácido bórico, em um balão volumétrico de 500 ml. Adicione cerca de 400 ml de água desionizada.
Agite o balão fortemente e ocasionalmente até que todo o sólido se dissolva. Pode demorar até uma hora. Espere chegar até a temperatura ambiente, e complete o volume até a marca de enrase do balão.
Será uma solução 0.1 mol/Lt (antiga 0,1 Molar) de ácido bórico.
Reações de Identificação:
Há uma prova de identificação que você pode fazer, se quiser.
Coloque um pouco de ácido bórico sólido em uma cápsula de porcelana, ou cadinho. Dissolva o ácido em álcool metílico, metanol. Álcool etílico ou isopropílico funcionam também. Adicione algumas gotas de ácido sulfúrico concentrado.
Acenda o conteúdo da cápsula com um fósforo. Se for ácido bórico, vai queimar com uma chama verde clara. que é devido à queima do éster inorgânico borato de metila, B(OCH3)3. E à promoção do életron do boro. Links: 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125 , 126, 127. 130. BRUDNA, R.L. “Boro e a Chama Verde.” Blog “Imagens da Tabela Periódica.“(2020). Após observar a chama, apague em seguida, com uma tela de amianto, do contrário o cadinho ou cápsula pode rachar, devido à dilatação desigual.
Esse teste da chama verde é característico e bem antigo. LENHER, V.; WELLS, J.S.C. J. Am. Chem. Soc. 21, 417, (1899) . As Raias de emissão do boro, já são conhecidas em 1873, e a cor da chama, antes, até. SALET, G. An. Chim. Phys. 6 (1873). CROOKES, W. Chem News J. Ind. Scienc. 27, 178 (1873). KANE, R. “Elements od Chemistry.” Editora Hodges and Smith, Dublin, Irlanda, pág. 532 (1841).
A cor verde maçã da chama dos compostos de boro, é conhecida a muito tempo, mas no começo, foi confundida com a cor do ensaio de chama do cobre ou do cloro. BALMAIN, W.H. Lond. Edin. Dub. Phil. Mag. 21, 270 (1842). LENHER, V.; WELLS, J.S.C. J. Am. Chem. Soc. 21, 417 (1899). FORBES, D. Lond. Edin. Dub. Phil. Mag. Series 4 11, 65 (1856). CROOKES, W. “The Chemical News and Journal of Physical Sciences.”, 29, Pág. 1 (1874). .
O Químico e Médico Francês Éttiene François Geoffroy descobriu esse teste para os compostos de boro, em 1735. GEOFFROY, E.F. Phil. Trans. Roy. Soc. 39, 37 (1735).
A identificação química do ácido bórico em solução, também pode ser facilmente feita, por reação em tubo de ensaio, pois ele forma um complexo marrom avermelhado, em presença de tintura, amarela, de Açafrão da Índia, Cúrcuma, (Curcuma longa L.). Veja Item 5, deste Artigo. Também Item 2, aqui.
Tintura alcoólica, ou melhor ainda, extrato acetônico. SILVERMAN, L.; TREGO, K. An. Chem. 25, 1264 (1953). WILSON, C.W. J. Am. Chem. Soc. 61, 2303 (1939). Link 48. 52. 53. 54 . 56. 70.
Preparo do reagente. Extrato acetônico de Açafrão da Índia. Se quiser, use tintura hidroálcoolica clássica. Ou tintura em álcool isopropílico. Veja estes artigos: 1, 2.
SILVERMAN e TREGO, loc cit., usaram curcumina reagente, dissolvida em acetona e Carbitol (monoetil éter do dietilenoglicol). Modifiquei o método, para usar reagentes e materiais mais fáceis de achar.
Pesar 16 g de pó de Açafrão da Índia (comprar), corresṕondente a 0,50 g. de curcumina, colocar em um frasco fechado e adicionar 10 ml de metilglicol (monometil éter do etileno glicol) e 90 ml de acetona pura.
Se não tiver, serve a acetona para unhas, que é uma solução de acetona a 60 % em álcool e água. E se quiser pode omitir o éter de glicol. Os extratos se formarão, mas com uma extração mais lenta.
Deixar em repouso, com agitação ocasional, por cerca de 10 dias. Filtrar a tintura e estocar em frasco âmbar, bem fechado.
Outra utilidade dos extratos e tinturas do Açafrão da Índia, é como indicador de pH , vira de amarelo a vermelho com bases, viragens reportadas em lit.: de 7,4-8,6, 7-9. 7-8. Acima de 7,5. Acima de 7,8.
Veja os tubos, da esquerda para a direita. O ensaio se executa assim. Em um tubo de ensaio, adicionar apenas água e algumas gotas da tintura ou extrato de Açafrão da Índia. É o tubo da esquerda.
Adicionar um pouco da solução do ácido bórico e um ácido mineral ou orgânico, clorídrico, sulfúrico, tricloroacético ou fosfórico servem, mas o melhor é ácido oxálico. Link 99. Aqueça o tubo numa lamparina de álcool (Item 4 deste artigo) ou bico de Bunsen, note a cor marrom alaranjada ou avermelhada, dependendo da concentração de ácido bórico. que se forma. Tubo do centro. Neste link e neste, reações semelhantes foram feitas por outros autores, mas em placa de toque.
Para comparar, no tubo da direita, é a viragem de pH do extrato de açafrão com carbonato de sódio. pH alcalino. Compare com este link. e este.
Resumo, extrato de Açafrão da Índia em água, reação dele com ácido bórico, e viragem do extrato em pH alcalino.

Dica de Químico: caso queira trabalhar com a Curcumina isolada, e não com os extratos brutos do Açafrão da Índia, uma dica, porque também já trabalhei com isso, a dois anos (FEDERMAN NETO, 2016).
Curcumina pode ser extraída do pó de Açafrão da Índia com vários solventes: Link 97, etanol, metanol, álcool isopropílico, acetona, Link 79. 83. Acetona ou metanol, metanol puro, etanol 80 %, etanol e água, acetona pura, link 84, 94. tampão aquoso ácido, hexano, Link 81 . 82, 95, Etanol puro, link 83, 85, 86, etanol com hexano, acetato de etila com clorofórmio, clorofórmio com metanol, benzeno, metanol, benzeno, acetato de etila, acetona ou etanol, metil-isobutil-cetona com clorofórmio e fenol, etanol com isopropanol, éter de petróleo, diclorometano, tolueno, álcoois etílico e terciobutílico, hexano, etanol e acetona, ácido fórmico, link 95, 96, clorofórmio e metilisobutil cetona, link 98. Álcool n-butílico.
Mas o melhor solvente para fácil extração é o clorofórmio puro, Links 80, 87, 88, 89, 90. 91, 92, 93. 98 Confirmei isso. A Curcumina pode ser isolada sólida e mais pura.
Para fazer o extrato e preparar a curcumina (uma mistura de curcuminóides, estruturas), você pode macerar 40 g. de pó de açafrão da Índia, em 120 ml de clorofórmio, por 15 dias, filtre o extrato, lave o açafrão no filtro com clorofórmio, e remova o solvente em um evaporador rotatório. O resíduo é práticamente a óleo resina, da qual o principal componente é Curcumina.
Outras reações de identificação que testei: Com nitrato de prata 2 %, forma-se uma opalescência branca, que escurece com formação de óxido de prata, e é solúvel em excesso de ácido bórico. O que se forma é o AgBO2 , metaborato de prata; reação com cloreto de bário 5 %, também uma leve opalescência branca, provavelmente de metaborato de bário, Ba(BO2)2.
Adicionando ácido bórico a uma solução de cloreto de cobalto, forma-se uma coloração levemente arroxeada, que se dissolve, de borato de cobalto (II), Co3(BO3)2. CHEN, Y.; LIU, Y.N.; YAN, W. J. Mat. Chem. A, 2 , 5903 (2014). Evaporando o líquido e calcinando o resíduo, obtêm-se uma cor arroxeada.
Compare com o “Ensaio da Pérola de Bórax“. ARDENGUI, I.; VIEIRA, G.. PERES, R.; GUEDES, M.; ROCHA, F. “Ensaio Preliminar Por Via Seca. Coloração da Pérola de Bórax.” (2014). Link 76 , do cobalto.
O ensaio da pérola de bórax foi inventado pelo Médico (depois Químico) Sueco Jons Jakob Berzelius. Em 1812. Ver: BERZELIUS, J.J.; WHITNEW, J.D. (Tradutor) “The Use of a Blowpipe in Chemistry and Mineralogy.” W.D Ticknor and CO.Boston, USA, Pág 71 e seguintes (1845). BERZELIUS, J.J. “Larbok I Kemien.“ Vol II, (1812). Livro em Sueco, Tradução automática do Titulo: “Tratado de Química.“. Tradução para o Alemão: BERZELIUS, J.J.. WOHLER, F. (Tradutor) “Lehrbuch der Chemie.” (1825). 7 volumes, várias edições. Tradução para o Francês. BERZELIUS, J.J.; JOUDAN, J.L.(Tradutor) “Traité de Chemie.” (1829-1833). Link 78. ABBRI, F. , Tradução em Veneto. O Livro de Berzelius é citado por: JORPES, J.E. “Jacob Berzelius, his Life and Work.” Univ. od California Press, USA, Vol. 7 (1970). E JENSEN, W.B. “The Development of Blow Pipe Analysis.” Cap. 10, Pág 1 (1986). Link 77.
O cloreto de níquel dá uma reação semelhante, mas forma uma cor amarelada do ortoborato de níquel (II), Ni3(BO3)2, GOTZ, W. Naturswisschaften, 50, 567 (1963). GRAFF, A. et al., J. Sol. Chem. 46, 25 (2017). BOUSHER, A. , J. Coord. Chem. 34, 1 (1995). FARMER, J.B. Adv. Inorg. Chem. 25, 187 (1982). Link 81.
Os complexos são solúveis em ácido bórico aquoso, e não precipítam nas condições que trabalhei, só a cor é observável. a precipitação só iria ocorrer em condições neutras ou básicas, seria então, borato, o precipitante, e não ácido bórico.
Mais uma reação simples de identificação. Coloque alguns mililitros de solução saturada de ácido bórico em um tubo de ensaio e junte gotas de nitrato de prata 2 %. Forma-se uma turvação branca, que aumenta com o aquecimento e é insolúvel em excesso de reagente, e bastante sensível a luz e ao calor, com escurescimento. a turvação branca é AgBO2, metaborato de prata. e o sólido escuro é óxido de prata, Ag2O. Bórax também dá a reação, maos fácilmente ainda, mas com formação de Ag2B4O7, tetraborato de prata. AGUS, O. et al., SN App. Scienc., 1, 662 (2019).
3. MEDINDO O pH DAS SOLUÇÕES:
Medindo o pH das soluções de ácido bórico (Item 2). Com papel indicador universal. Solução saturada, 4,0; solução 0,1 mol/Lt, 5,0.
Com phmetros, de bancada e de bolso, calibrados. Protocolo de medição. Solução saturada, com o phmetro de bancada, 3,79; com o phmetro de bolso, 3,7 . Solução 0,1 mol/Lt, com o phmetro de bancada 5,32; com o phmetro de bolso, 5,4.
Comparação com a literatura: pH da solução saturada de ácido bórico. 3,1-4,4; pH da solução 0,1 mol/Lt (100 mM), 5,12. 5,29. A solução mais concentrada tem pH mais baixo. Isso é conhecido para ácido bórico.
4. INTERAÇÃO ENTRE O ÁCIDO BÓRICO E UREIA:
Como veremos na discussão dos resultados, o átomo de boro do ácido bórico pode receber um par de elétrons de certas bases, atuando como ácido de Lewis.
É conhecido que o ácido bórico forma um complexo, aduto de Lewis, com a uréia. Mas mostra um comportamento de ácido prótico e de Lowry-Bronsted fraco. LI, Q.; XUE, F.; MAK, T.C.W. Inorg. Chem. 38, 4142 (1999).
Eu esperava uma complexação da ureia com o ácido bórico. Isso deveria alterar o pH das misturas de ureia e ácido bórico. Foi isso que testei.
Preparar uma solução aquosa de ureia a 0,1 mol/Lt (cerca de 0.6 %), de maneira convencional. Pipetar 10 ml com pipeta volumétrica e misturar com 10 ml da solução 0,1 mol/Lt de ácido bórico (Item 2).
Medindo o pH, com o phmetro de bolso, calibrado, e usando este protocolo de medida: Solução de ácido bórico, 5,1 (Lit. . 5,1, BUDAVARI et al., Loc. Cit., a) e pH da solução de ureia, 6,8 (Lit. 7,2, sol. a 10 %, BUDAVARI et al., Loc. Cit., b.). De fato, a uréia é praticamente neutra, e não se dissocia em água.
Livro, exemplar pertencente ao Autor do Blog: BUDAVARI, S. et al. “The Merck Index.”, Merck & CO. Inc., Whitehouse Station. N.J., U.S.A. 12a Ed. a); Pág. 219. Monografia 1264 e b); Pág. 1683, Monografia 10005 (1996). Merck Index Online. Link 80. 1a edição Histórica. 9a edição. 10a edição. 13a edição, completa. 14a edição.
Agora medindo o PH da mistura de ácido bórico e ureia. 5,9-6,0. Nota-se que não há muita variação. Para a discussão dos resultados, vá para o Item 7.
5. SELECIONANDO INDICADORES PARA O ÁCIDO BÓRICO:
Vamos escolher um indicador de pH para o ácido bórico.
Preparamos uma solução de um indicador para soluções muito ácidas. Escolhi o verde malaquita, para mostrar a viragem. Podia ter usado o violeta de metila ou o vermelho do congo. Também fizemos uma solução de um indicador para ácidos fortes ou semi-fortes, o alaranjado de metila, o mais clássico dos indicadores para ácido.
Pode seu visto na imagem. Como esperado, o ácido bórico é muito fraco, e não provoca a viragem desses indicadores. o controle positivo foi feito com água acidulada com ácido clorídrico (ácido prótico forte).

Nos copos de bequer, de cima para baixo, da esquerda para a direita. A. Verde de Malaquita, cor azul esverdeado; B. com ácido bórico (não há viragem); C. Controle positivo, água acidulada com ácido clorídrico, viragem para verde. Embaixo, D. alaranjado de metila, ao centro, E., não há viragem com ácido bórico. F. à direita, controle positivo, água acidulada com ácido clorídrico, viragem para vermelho.
Precisamos trabalhar com indicadores para um pH próximo de 5.
Ocorre que há um antigo e muito clássico método de dosagem de nitrogênio, que o converte em sila de amônio, depois em amônia, e essa amônia é recebida em solução de ácido bórico e titulada. Se chama “Método de Kjeldahl“. Do Químico Dinamarquês Johan Gustav Christoffer Thorsager Kjeldahl.
KJELDAHL, J. Ztschr. An. Chem. 22, 366 (1883). Citado por: VICKERY, H.B. Yale J. Biol. Med. 18, 473 (1946). Algumas modificações: HILLER, A.; PLAZIN, J.; VAN SLYKE, D.D. J. Biol. Chem.176, 1401 (1948). MEEKER, E.W. ; WAGNER, E.C. Ind. Eng. Chem. An. Ed. 5, 396 (1933). WAGNER, E.C. Ind. Eng. Chem. An. Ed. 12, 771 (1940). ANDERSON, D.J. Biochem. J. 45, 31 (1949). PEPKOWITZ, L.P.; SHIVE, J.W. Ind. Eng. Chem. An. Ed. 14, 514 (1942). ARAÚJO, M.J. ; OLIVEIRA, C.W. (2019). FONTANA, P. Mem. Inst. Oswaldo Cruz, 51, 277 (1953). SAÉZ-PLAZA, P. et al. Crit. Rev. An. Chem. 43, 178 (2013). MICHALOWSKI, T. et al. (2013). UGRINOVITS, MGLH, 71, 124 (1980). SÁEZ-PLAZA, P. et al., Crit. Rev. An. Chem. 43, 178 (2013). MICHALOWSKY, T. et al., J. Chem. Educ. 90, 191 (2013).
O método de Kjeldahl é muito conhecido e usado, e foi muito modificado, no correr desses 136 anos. Links 13, 14. 15.
Pelo trabalho com o método, observou-se que dois indicadores mistos são ótimos para usar com o ácido bórico. O vermelho de metila/azul de metileno . Indicador de Tashiro, Link 61. Link 102. 103. E o vermelho de metila/verde de bromocresol (Links: 52, 53 , 54, 55, 56, 57, 58, 59, 60). São os que iremos usar.
Os indicadores mistos foram preparados como indicado neste link. Eles tem viragens em cerca de 4,8 a 5,4.
Observe:

Nos tubos, da direita para a esquerda. G. Indicador misto de vermelho de metila/azul de metileno; H. viragem com ácido bórico, de azul para verde. I. Terceiro tubo, indicador de vermelho de metila/verde de bromocresol. J. Quarto tubo, viragem com ácido bórico, de vermelho para marrom avermelhado.
O controle positivo foi feito, acidulando fortemente, com ácido clorídrico, o conteúdo dos tubos H e J. As viragens mudam de cor, respectivamente, de verde e marrom avermelhado, para azul escuro e para vermelho – laranja.

Desse modo, conclui-se que esses indicadores mistos indicam o ácido bórico, fraco, e o diferenciam de um ácido forte, como o clorídrico.
6. COMPLEXAÇÃO E AUMENTO DA ACIDEZ:
A ideia é adicionar um complexante, capaz de doar um par eletrônico ( base de Lewis) ao orbital vazio do átomo de boro (ácido de Lewis). Desse modo, diminuindo a densidade eletrônica sobre os três grupos hidroxi, tornando os hidrogênios mais lábeis, mais ácidos.
Isso deve aumentar a acidez das soluções de ácido bórico.
De acordo com outros autores, [ROY, G.L.; LAFERRIERE, A.L.; EDWARDS, J.O. J. Inorg. Nuclear Chem. 4, 106 (1957)], o aumento da acidez do ácido bórico em presença de açucares, teria sido observado pela primeira vez, em 1842, pelo Químico Francês Jean Baptiste Biot, que foi professor de Pasteur. Porém não encontrei a menção ao experimento, no artigo original de Biot. BIOT, J. Compt. Rend. Hebdo. Sceanc. Acad Scienc. 14, 49 (1842).
Vários doadores de elétrons (complexantes) foram testados, misturando solução 0,1 mol/Lt de ácido bórico, com excesso do reagente complexante, e medindo o pH. Aminas foram evitadas, porque são básicas e a tendência seria sempre aumentar o pH, e não diminuir.
Foram testados: álcoois [metanol (álcool metílico), etanol (álcool etílico) e álcool isopropílico (isopropanol) (propan-2-ol) (propanol-2)]; cetonas [acetona e acetilacetona (2,4-pentanodiona)]; glicóis (etilenoglicol, propilenoglicol e metilglicol [(2-metoxietanol, Metil Cellosolve ou etilenoglicol monometiléter)] e polióis [glicerol (glicerina) e manitol].
Os melhores efeitos de aumentar a acidez, baixar o pH, foram obtidos com o glicerol, e principalmente, com o manitol e a frutose.

Nos tubos de ensaio, da esquerda para a direita. Tubo K. Ácido bórico com indicador de vermelho de metila/verde de bromocresol; L. Adicionando solução de manitol, o pH vai de 5 para 3; M. Indicador de alaranjado de metila, para ácidos semifortes, não há viragem com ácido bórico; N. Ao adicionar solução de manitol, o pH cai de 5 para 3, chegando quase à viragem do alaranjado de metila, que fica avermelhado.
Resultados com a frutose. Tubo da esquerda, O. Ácido bórico, 0,1 mol/Lt, pH com indicador misto de vermelho de metila/verde de bromocresol e, frutose sólida adicionada. um pedaço de papel universal foi adicionado para comparar.. Cor vermelho alaranjado, pH 3-3,5. Tubo P., somente o ácido bórico, pH 5.

Um pequeno experimento complementar foi feito. Medi (papel indicador universal), o pH da solução saturada de ácido bórico (Item 2) cerca de 4,5. Ao saturar a solução com manitol sólido (marca Becton-Dickinson, Difco), o pH cai imediatamente para 3, confirmando meus resultados anteriores.
Os resultados estão sumarizados e discutidos na seção 7.
7. RESULTADOS E DISCUSSÃO:
Dissociação e Neutralização do Ácido Bórico.
O que os valores de pH do ácido bórico indicam? Indicam que o ácido bórico é fraco e muito pouco ionizado em solução aquosa, principalmente em solução diluída.
De fato, mesmo tendo em teoria, 3 hidrogênios ionizáveis:
H3BO3 + 3 H2O = 3 H3O + + BO3 -3
Em solução diluída (ex. 0,1 mol/Lt) quase nada dele se dissocia. prevalecem as espécies não ionizadas. Está na forma de H3BO3 associado por pontes de hidrogênio. NICKERSON, R.F. J. Inorg. Nuclear Chem. 33, 1665 (1971).
Em soluções mais concentradas, como a saturada, ele pode ionizar um pouco só, apenas em um dos seus hidrogênios, agindo como um ácido prótico, de Arrhenius normal. Links: 17, 18, 19 e fraco, com formação do íon H2BO3-, ácido metabórico, metaborato. Link 6, ZHU, F. et al.. Phys. Chem. Liquid 55, 185 (2017). Para ácidos de Arrhenius, veja este artigo,
H3BO3 + H2O = H3O + + H2BO3 –
Além disso, nessas soluções concentradas (e aumentando um pouco a acidez, como vimos nas medidas de pH) o que se dissocia é a água,
2 H2O = H3O+ + OH-
E o ácido bórico, fraco, funciona não como mais como ácido prótico, mas ácido de Lowry-Bronsted, conjugado, fraco, cedendo o próton para a espécie tetrahidroxiborato (base de Lowry-Bronsted forte). Link 18. 19. 20. CROVETTO, R.; CORTI, H.; PRINI, R.F. J. Chem. Soc. Faraday Trans. 1, 76, 2179 (1980). Isso deveria aumentar a acidez. STETTEN Jr., D.W. An. Chem. 28, 1177 (1951).
H3BO3 + OH- = B(OH)4 –
B(OH)4 – + H+ = HB(OH)4
Assim, com hidróxido de sódio, um dos hidrogênios pode ser neutralizado, como se fosse ácido pŕótico, mas a neutralização pode também ser encarada pela teoria tipo Lowry-Bronsted. Link 13, 14, 15,
H3BO3 + NaOH = Na[B(OH)4]
A reação global é mais complexa que isso, pois há reações das espécies com água, e prótons, e ânions de poliborato podem se formar. Links: 7,8, 9, 10, 11. PERELYGIN, Y.P.; CHISTYAKOV, D.Y. Russ. J. App. Chem. 79, 2041 (2006). ANDERSON, J.L. et al. J. Phys. Chem. 68, 1128(1964). WARD, G.K.; MILLERO, F.J. J. Sol. Chem. 3, 417 (1974).
Ácidos e bases de Lowry-Bronsted, teoria do Químico Dinamarquês Johannes Nicolaus Brönsted e do Inglês Thomas Martin Lowry. LOWRY, T.M. J. Soc. Chem Ind. 43 (1923). Link 37. BRONSTED, J.N. Rec. Trav. Chim. Pays-Bas 42, 718 (1923).
Outra possibilidade para se equacionar a reação, é empregar o conceito de ácido e base de Lewis. Links 25, 26, 27, 28, 29. 30, 31. 32. LEWIS, G.N. “Valence and the Structure of Atoms and Molecules.” Monograph of the American Chemical Society (1923). Link 22.
O ácido bórico, ao mesmo tempo que é ácido de Lowry-Bronsted, também o é de Lewis.
B(OH)3 + H2O = B(OH)4- H+ ácido de Lowry-Bronsted.
Pois o boro tem orbital vazio, então pode ser ácido de Lewis, recebendo o par eletrônico da hidroxila. Links: 33, 34, 35, 36.
H2O = H+ + OH-
B(OH)3 + OH- = B(OH)4 – ácido de Lewis.
De qualquer modo,um só dos hidrogênios do ácido bórico pode ser neutralizado com relativa facilidade.
Interação com a Ureia.
Nos experimentos misturando o ácido bórico com a ureia, (Item 4) dever-se-ia esperar uma alteração de pH, pela complexação em solução, mas quase não há variação.
Pois essa complexação ocorre, formando um aduto ureia/ácido bórico, 1:1 e/ou não estequiométrico e/ou polimérico. Link 21. A capacidade da ureia de funcionar como base de Lewis, foi demonstrada pelo muito famoso Químico Americano Linus Carl Pauling. PAULING, L. Proc. Natl. Acad. Scienc. USA, 18, 293 (1932).
De fato, se um dos hidrogênios do ácido bórico fosse apreciavelmente de caráter prótico, se deveria esperar uma subida do pH. É conhecido que a ureia aumenta a ionização da água e diminui a atividade dos prótons, quando em presença de ácido prótico. BULL, H.B.; BREESE, K.; FERGUSON, G.L.; SWENSON, C.A. Archiv. Biochem. Biophys. 104, 297 (1964).
O resultado do experimento (Item 4) sugere que em solução, mesmo um só dos hidrogênios do ácido bórico, não é apreciavelmente prótico, e que a ureia não atua, porque o faria facilmente só com ácido prótico.
.Apesar disso uma neutralização de um só dos hidrogênios para formar metaborato, NaH2BO3, é a muito tempo, conhecida. PRIDEAUX, E.B.R; WARD, A.T. . J. Chem. Soc. Trans. 125, 69 (1924). PRIDEAUX, E.B.R. Trans. Faraday Soc. 11, 76 (1915).
Complexação com o Manitol e Outras Bases de Lewis.
Como vimos no Itens 4 e 6, a ideia é bloquear o orbital vazio do átomo de boro, (ácido bórico como ácido Lewis) através de uma complexação com uma base de Lewis, doadora de elétrons.
Foram testadas várias substâncias, em reação de complexação com o ácido bórico. É conhecido que ácido bórico reage com amônia, Link 48, aminas, Link 68, 75. cetonas, certos álcoois, Link 48, polióis, Link 47 , 65. açucares, Links: 43, 44, 45, 46. 69. fenois e glicóis. Link 51. SHAO, C. et al. An. Scienc. Japan, 17 Supp. il475 (2001). ISHIBASHI, M.; FUJINAGA, T.; NAGAI, T. Bull. Inst. Chem. Res. Kyoto Univ. 36, 134 (1958).
Embora o glicerol possa ser usado, o melhor desses complexantes parece ser o manitol, um poliól derivado do açucar manose Link 33. Obtido por fermentação, ou por hidrogenação da frutose. Assim fica bem estabelecido em literatura, que o manitol parece ser o melhor complexante. AZEVEDO, M.C.C.; CAVALEIRO, A. J. Chem. Educ. 89, 767 (2012). HOLLANDER, M.; RIEMAN III, W. J. Chem. Educ. 17, 602 (1945). MILLER, F.J.; THOMASON, P.F. Talanta, 2, 109 (1959). MAGNUSSON, L.B. J. Inorg. Nuclear Chem. 33, 3602 (1971). BELCHER , R.; TULLY, G.W.; SVEHLA, G. An. Chim. Acta, 50, 261 (1970). Link 34, 35, 36, 37, 38, 39, 40, 41, 42, 49 , 72.73.
A presença do complexante diminui (por repulsão) a densidade eletrônica sobre as hidroxilas, aumentando a acidez do ácido bórico. Link 33. BEZERRA DA SILVA, M. et al., Cryst. Growth Des. 16, 6631 (2016). ROSS, S.D.; CATOTTI, A.J. J. Am. Chem. Soc. 71, 3563 (1949). KNOECK, J.; TAYLOR, J.K. An. Chem. 41, 1730 (1969). NICKERSON, R.F. J Inorg. Nuclear Chem. 30, 1447 (1969). CAMPBELL Jr., G.W. J. Inorg. Nuclear Chem. 31, 2625(1969). A quantidade de ácido bórico livre no líquido, diminui, e a do ácido complexado, mais forte, aumenta. DYDO, P. J. Memb. Scienc. 429, 130 (2013).
Assim, adicionou-se os complexantes à solução do ácido bórico (Item 6), e o pH foi medido e comparado com o da solução de ácido bórico pura.
Para os álcoois simples, como metanol e isopropanol (pH vai de 5 a 6) e principalmente, etanol (pH vai de 5 a 7), o efeito observado foi inverso. o pH aumentou, solução mais básica. Resultado inesperado!
Aparentemente, álcoois monohidroxilados não devem reagir bem com ácido bórico aquoso. SHIBAYAMA, M. et al., Polymer, 29, 336 (1988). Pensei de início, em retrodoação, “back donation“, mas ela não parece ocorrer em complexos de boro com álcoois, apenas nos haletos de boro.
Especulo que algum éster, borato de alquila, se forme, e sua hidrólise libere hidróxido. Veja: STEINBERG, H.; HUNTER, D.L. Ind. Eng. Chem. 49, 174 (1957). WASHBURN, R.M. et al., Adv. Chem., 23, Cap. 12, 129 (1959). Boratos de alquila são facilmente hidrolisados.
Também esse aumento de pH nos complexos de ácido bórico com polióis, foi notado por: ROY, G.L.; LAFERRIERE, A.L.; EDWARDS, J.O. J. Inorg. Nuclear Chem. 4, 106 (1957). Os autores o atribuiram a uma complexação do ânion borato, e não do ácido bórico.
Com acetona e pentanona-2,4 não tive variação de pH observável. Assim com com os glicóis (etilenoglicol, propilenoglicol e metilglicol). Com a glicerina, o pH baixa de 5 para 4.
Também com o açucar frutose (mas não com glicose ou sacarose). pH baixa de 5 para 3,5.
É conhecido que a acidez do ácido bórico aumenta por complexação com açucares. Mas os efeitos maiores, são mesmo com a frutose e o manitol (Item 6), pH baixa de 5 ou 4 para 3 ou 3,5, confirmando as muitas observações de literatura. Veja “Complexação com o Manitol“. Manitol frutose e sorbitol são considerados os melhores complexantes.
Sumarizando, através de equações:
Sem a adição de manitol:
H2O = H+ + OH- Dissociação da Água.
B(OH)3 + OH- = B(OH)4 – H+
O hidróxido funciona como base de Lewis. O HB(OH)4 é um ácido prótico ou de Lowry-Bronsted, fraco. Os compostos de boro são ótimos ácidos de Lewis.
Com a adição de manitol:
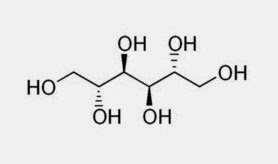
Representemos o grupo de manitol por MANIT-(OH)2:
B(OH)3 + 2 MANIT-(OH)2 = B(O-MANIT)2 + 3 H2O + H+
As hidroxilas complexam com o ácido bórico, preenchendo os orbitais vazios do boro. REZA ZAREI, A.; NOBAKHT, S.; ZAREE, M.A., Orient. J. Chem. 28, 1591 (2012). Link 71.
O manitol funcionou como a base de Lewis. Isso dificulta o ataque do ânion hidróxido (os orbitais estão ocupados), e torna o ácido bórico mais forte.
Na realidade o complexo que se forma pode ser com apenas uma molécula de manitol , ou duas. Link 73, 74, 75.
8. EXPERIMENTOS COMPLEMENTARES:
Alguns autores fizeram amplos estudos sobre o sistema bórico-borax, que confirmam e ampliam meus experimentos. THORSTEN, C. “Chemistry of the Borate-Boric Acid Buffer System.” (2013).
Como vimos, a ionização do ácido bórico é sui generis e desvia das equações de Nerst e do equilíbrio de Arrhenius.
Resolvi complementar o Artigo, preparando uma solução tampão de bórax-ácido bórico. Tampões desse tipo podem ser feitos com neutralização ou acerto de pH, Links 100, 101, 102,
Mas resolvi fazer um, por dissolução direta. O sistema ácido bórico-bórax, pode ser usado para a faixa de pH 6,8-9,2. Exemplo, literatura: 4 g de ácido bórico e 20 g de bórax por litro, pH cerca de 9,2.
A razão para eu escolher um experimento com um tampão desse tipo, é que os tampões de ácido bórico-bórax são importantes para o uso em experimentos de Eletroquímica. Exemplos, links 103, 104, 105, 106.
Vamos calcular o tampão ácido-borico bórax. Existem calculadores online, são práticos e fáceis de usar, mas em geral, são para ácidos monopróticos e suas bases conjugadas. Links: 107, 108, 109, 110, 111, 112, 113.
O ácido bórico é fraco e tem três hidrogênios, como vimos, um só é prótico. Por isso resolví calcular o tampão, as proporções. Adaptei o método de “Mdfenko“. MDFENKO, “Protocol Online“, J. Biol. Met. (2009).O método usa a equação de Henderson-Hasselbach.
Ele calculou para um tampão 0,15 mol/Lt, e pH 8,3. Eu calculei adaptando o método para um tampão 0,1 mol/Lt, pH 7. Usei o pKa principal do ácido bórico, 9.14. Outro Link. Tem três pKs. Vejam os cálculos:
Tampão Borato-Ácido Bórico, 0,1 mol/Lt, pH 7. Bórax, fórmula Na2B4O7.10H2O, mol = 381,37; Ácido Bórico, H3BO3, mol = 61,83.
pKa1 do ácido bórico, 9,14. pH desejado, 7, concentração 0.1 mol/Lt.
pH = pKa + log / = *
7,0 = 9,14 + log /
/ = antilog de (7,0 – 9,14) (antilog calculado por este software online)
/ = antilog de ( – 2,14) = 0.072 = /
Proporção entre o ácido e o bórax:
1 ÷ / = 1 ÷ 0.072 = 13,89 Nota: Obtem-se uma aproximação para 13,04, usando um calculador online.
Aplicando a *
0,1 mol/Lt = 1x + 13,89x
x = 0,1 ÷ 14,89 = 0.0067
0,1 mol/Lt = 0.0067 mol/Lt bórax + 0,0933 mol/Lt ácido bórico
Calculando a massa de bórax e ácido bórico:
n = C.V / 1000 e n . mol = massa
n = número de moles, m, em gramas, mol, C, concentração molar, V. volume em mililitros
Assim, para fazer 100 ml de uma solução tampão 0,1 mol/Lt de bórax-ácido bórico:
Massa de bórax:
(0,0067 x 100) /1000 = 0,00067 x 381,37 = 0,2555 g. de bórax.
Massa de ácido bórico:
(0,0933 x 100) /1000 = 0,00933 x 61,83 = 0,5769 g. de ácido bórico.
Preparo da solução:
Como usei uma balança de 3 casas decimais, veja Item 6, neste Artigo, pesei 0.578 g. de ácido bórico e 0,255 g. de bórax, e dilui em balão volumétrico de 100 ml.
Agora os testes do pH. com papel indicador universal, mediu entre 7 e 7,5. Com o phmetro de bancada do laboratório (Artigos neste Blog: 1, 2, 3, 4, 5, 6) calibrado e usando o protocolo publicado, mediu 7,08.
Portanto em boa congruência com o resultado esperado. um tampão neutro de ácido bórico-bórax.
9. CONCLUSÃO:
As características sui generis da dissociação e ionização do ácido bórico, (podendo funcionar como ácido prótico, de Lowry-Bronsted ou de Lewis), são discutidas e demonstradas com alguns experimentos simples.
A pequena redução do pH quando a ureia foi usada como complexante, sugere que os hidrogênios do ácido bórico tem pouco caráter prótico.
A complexação do ácido bórico com bases de Lewis, eficientes como doadoras de elétrons (principalmente a glicerina, e mais ainda a frutose e o manitol), libera próton e além disso, bloqueia o átomo de boro, impedindo o ataque do ânion hidróxido (proveniente da água) e tornando os hidrogênios mais ionizáveis.
O efeito é mais pronunciado usando o manitol como complexante.
Foi demonstrado que isso aumenta muito a acidez do ácido bórico, tornando-o um ácido de Lowry-Bronsted mais forte.
Os resultados dos experimentos foram complementados calculando e preparando uma solução tampão de bórax-ácido bórico, pH 7.

