
Autoria: Alberto Federman Neto, AFNTECH.
Revisto e Ampliado em: 24 de Junho de 2022.
Neste Artigo, reporto reagentes e/ou realizo experimentos com algumas reações químicas antigas, que, ao longo do tempo caíram em desuso ou estão relativamente esquecidas.
Elas não constam mais em muitos livros texto modernos de Química Experimental. mas ao meu ver, são ainda interessantes do ponto de vista Histórico. Didático ou Químico.
A imagem que ilustra o topo deste Artigo é uma página de um antigo livro, descrevendo experimentos de Alquimia e/ou Química. É o livro escrito pelo Alquimista autodidata Inglês John Bate, 1634. Link 1. BATE, A.; MAB, R. (Editor); JACKSON, J.; CHURCH, F. (Livreiros) “The Mysteryes of Nature and Art.”, Londres, Inglaterra (1634).
Esse livro teria influenciado o famoso Filósofo, Filósofo Natural, Matemático , Astrônomo e Físico Inglês Sir Isaac Newton, pois este, ao contrário do se pensava antigamente, pois era considerado muito racionalista, também estudou, praticou e valorizou muito a Alquimia. SCHILT, C.J. Ambix, 67, 400 (2020). Links: 2, 3, 4, 5. 6.
Neste link, alguns interessantes Artigos de Alquimia de Newton.
Newton também foi influenciado pelas obras do Médico, Escritor, Filósofo Esotérico e Alquimista Americano (nascido nas Bermudas, território Inglês) George Starkey. Starkey também escreveu sob o pseudônimo de Eirenaeus Philalethes.
1. INTRODUÇÃO:
Quando pertinente, faço uma pequena introdução sobre a História e a descoberta de cada reação.
2. VELHO REAGENTE. ÁGUA DE CLORO:
Cloro Gás e Água de Cloro:
O uso de água de cloro ou de bromo, a muitos anos não é mais corrente nos laboratórios ou nos livros, possivelmente por não ser considerada prática e por esses reagentes serem instáveis e de conservação difícil.
Entretanto, experimentos interessantes pode ser feitos.
Quando eu comecei a estudar Química, em 1971, e durante meia década de 70, pelo menos, cheguei a fazer e usar água de cloro e/ou água de bromo várias vezes.
Era descrita em antigos livros clássicos de Química Geral e Inorgânica. MELLOR, J.W. “Modern Inorganic Chemistry.” Editora Longmans, Green & Co., Londres, Inglaterra, Pág. 301 (1922).
Tenho inclusive uma edição impressa, tradução desse excelente livro: MELLOR, J.W.; PARKES, C.D. (Revisor); CALDAS, A. (Tradutor), “Química Inorgânica Moderna.” Editora Globo, Porto Alegre, R.S., Vol. II, Pág. 615 (1967). O livro pode ser comprado no Brasil, a custo baixo, e eu recomendo a quem gosta de Química Inorgânica.
História do Cloro e da Água de Cloro e Compostos Relacionados:
Oficialmente, o cloro, água de cloro e os hipocloritos foram descobertos pelo Farmacêutico e Químico Sueco/Germânico (nascido na Pomerânia) Karl Wilhelm Scheele, em 1774. LENNARTSON, A. “The Chemical Works of Karl Wilhelm Scheele. Springer, Estocolmo, Suécia” (2017). Versão Online. Outro Link. Link 7. BALDWIN, R.T. J. Chem. Educ. 4, 313 (1927).
O cloro foi descoberto ao estudar um mineral, a Pirolusita, dióxido de Manganês, que Scheele chamava “Magnesia Nigra“, Magnésia Preta.
Ele oxidou o ácido clorídrico concentrado e formou o “Espírito de Sal Deflogisticado“, gás cloro. Publicado na Academia de Ciências de Estocolmo, Suécia. SCHEELE, K.W.; Kong. Vetenskaps Academiens Handlingar 35, 89-116 (1774), Tradução para o Inglẽs por Alembic Club, da Universidade de Manchester, Inglaterra, e coletada por GIUNTA, C. (1996).
Muitos dos seus trabalhos foram publicados em Sueco , na Revista Kongl. Vetenskaps Academiens Handlingar (Transactions of the Royal Swedish Academy of Sciences). Algumas coisas ele publicou em Alemão. Mas por publicar muito em Sueco, demorar para escrever e por não se aprofundar no estudo de determinados tópico, muitos dos inéditos e inovadores trabalhos de Scheele permaneceram obscuros e pouco conhecidos.
Mas Scheele era brilhante, e foi um dos maiores experimentalistas do seu tempo. Descobriu inúmeros compostos e vários elementos químicos. MARSHALL, J.L. Hexagon, 96, 2 (2005).
Mas alguns Autores sugerem que o cloro e a água de cloro podem ter sido observados e preparados mesmo antes de Scheele, por alguns Alquimistas como O Árabe chamado Geber ou Gabir, link 9, o Alemão Johann Rudolf Glauber e o Belga Jan Baptiste Van Helmont. WISNIAK, J. (2002). WISNIAK, J. Indian J. Chem. Technol. 9, 450 (2002).
O gás cloro, análogo ao que Scheele obtivera, foi liquefeito pelo Físico e Químico Inglês Michael Faraday, FARADAY, M. Phil. Trans. Roy. Soc. London, 113, 160 (1823),
e reconhecido como elemento químico simples, pelo Químico Inglês Humphry Davy DAVY, H. Phil. Trans. Roy. Soc. London, 100, 231 (1810). DAVY, H. Phil. Trans. Roy. Soc. London 101, 155 (1811). DAVY, H. Phil. Trans. Roy. Soc. London, 108, 169 (1818). SIEGFRIED, R. J. Chem. Educ. 36, 568 (1959).
Observados por Scheele, os hipocloritos foram redescobertos e modernizados pelo Químico Francês Claude Louis Bertholet. Hipoclorito de Potássio. a partir de 1785. “Chamava-se “Água de Javel” BERTHOLLET, C.L; KERR, R. (Tradutor) “Essay on the New Method of Bleaching…” Editora Linen and Hempen Manufacture, Dublin, Irlanda (1790). LEMAY, P. Rev. Hist. Pharm. 21, 99 (1933). BERTHOLLET, C.L Ann. Chem. 151 (1789).
Atualmente, o hipoclorito de sódio, NaOCl § é o componente ativo da “Água de Lavadeira“, “Água Sanitária” e do “Cloro Líquido“, O “Cloro Sólido de Piscina“, HTH, é o hipoclorito de cálcio Ca(OCl)2 §.
§ Em literatura antiga, comum se escrever hipocloritos como “NaClO” , link 10, mas isso resulta em uma fórmula incorreta, pois o sódio forma um sal no oxigênio e não no átomo de cloro.
Ao dissolver-se em água, o cloro gasoso vai formar a “Água de Cloro“, uma mistura de ácidos clorídrico e hipocloroso. O ácido só fica estável em solução.
Cl2 + H2O = HCl + HOCl
O ácido hipocloroso foi descoberto pelo Farmacêutico e Químico Francês Antoine Jérôme Balard em 1834. BALARD, A.J. “Recherches sur la Nature des Combinasions Décolorants du Chlore.” Editora Isidore Tournel Ainé, Montpellier, França (1834). SUMAN, S. “Hypochlorous Acid.” Exame de Qualificação para Mestrado.” (2022).
Mas a Química dos Hipocloritos só foi bem esclarecida entre 1840 e 1870, por vários pesquisadores. DE LUCA, S. Am. J. Pharm. 471 (1875). ODLING, W. “Outlines of Chemistry.” Longmans, Green & Co., Londres, Inglaterra, Págs. 23, 24 (1870). JONES. F. “The Owens College Junior Course of Practical Chemistry.” MacMillan & Co., Londres, Inglaterra, Págs. 31, 32, 108, 112 (1872). KINKZETT, C.T. J. Chem. Soc. 28, 404 (1872). KAVANAGH, B. Am. J. Pharm. 11, 226 (1845). MILLON, M.E. Am. J. Pharm. 5, 311 (1840).
Assim borbulhando cloro gasoso em água, vimos, prepara-se a “Água de Cloro“.
Preparação de Cloro Gás e Água de Cloro em Laboratório:
Para fazer cloro, Cl2, poderíamos usar a reação clássica, oxidar o ácido clorídrico com bióxido de manganês, AMARO, T. (2014). links: 11, 12, 13, 14, 15, 16, 17, 18, 19, 20. 23. 31. 45. 48 . Outros oxidantes: permanganato de potássio, links 21, 22, 31, 32. 49. 51. dicromato de potássio. Links: 24, 25, 26, 27. 28, 29. MATSIMBE, G. “Obtenção do Cloro e Identificação dos Seus Iões.” (2021).
Embora didáticas, essas reações são antigas, pouco práticas e obsoletas. Mesmo industrialmente, cloro é obtido por eletrólise.
No laboratório, recomendo usar, muito mais prático e barato, usar os hipocloritos como fontes de cloro. A “Água Sanitária” ou o “Cloro Líquido” de Piscina. Facilmente achados no comércio. Eventualmente, pode usar o “Cloro de Piscina Sólido”, mas é mais caro. STRAUSS, F.J. et al. React. Chem. Eng. 6, 135 (2016). Mesmo algo mais sofisticado, como ácido tricloroisocianúrico, pode ser usado. 55.
Tratar a “Água Sanitária” , 5 % de cloro, ou o “Cloro Líquido“, 10 a 16 % de cloro , comerciais com ácido clorídrico ou muriático (ácido clorídrico de grau de pureza industrial). Link 41. 42. 35.
As proporções dos reagentes não são críticas. Faça em capela de exaustão ou em ambiente aberto, tipo quintal, porque o cloro é muito tóxico. Você vai observar o cloro na forma de um gás denso e verde claro.
Use uma aparelhagem de laboratório montada para recolher gases, como mostrado nesses vídeos e figuras: 31, 32, 33, 34, 35, 36, 37, 38, 39. 45. 46. 47.
Se quiser apenas observar a formação do cloro, pode faze-lo em um balão, link 40. 41, 42, 43, 52. proveta grande, frasco esmerilhado, ou mesmo em um pote, “vidro de palmito”.
Coloque o hipoclorito, acidule com ácido clorídrico, e tampe o frasco frouxamente. Observe o gás verde que se forma.
Frasco com cloro líquido comercial, parcialmente como gás. Fonte da Imagem, ExportersIndia.

Para preparar a “Água de Cloro”, você precisa borbulhar o cloro gasoso em água fria ou a temperatura ambiente.
Cl2 + H2O = HCl + HOCl “Água de Cloro”
Isso que eu fazia quando estudava no curso técnico. Essa é a reação esquecida, que caiu em desuso.
Água de cloro pode ser usada como reagente para deslocar bromo ou iodo a partir dos seus haletos. NUNES, D.G.; PATERNOSTRO, F.P.; CASTRO MARTINS, I.; MARTINS, L.S.A. (2012).
Há uma maneira prática de gerar água de cloro, mas em presença de outros compostos, sais de sódio. 53. Ela se baseia nas reações gerais da conversão de hipocloritos em cloro. Há modificações desse método. 44.
Simplesmente, acidule a “água sanitária”, gelada, com um pouco de ácido clorídrico, ou melhor ainda acético (ácido fraco).
NaOCl + HOAc (ou HCl) = HOCl + NaOAc (ou NaCl)
A água de cloro gerada, porém, conterá sais, mas isso não a invalida nas reações características, e é grande simplificação sobre a necessidade de se trabalhar com o cloro gasoso, bem menos conveniente..
Então, recordamos velhas e esquecidas reações, a preparação da “Água de Cloro” e seu uso.
Ela, assim como o hipoclorito de cálcio, chamado “Cloreto de Cal” eram bem usados como reagentes, nos tempos antigos… KONINCK, L.G. “Mémoire sur lers Proprietés et Analyse de la Phlordizine.” Editora Vanlithout et Vandenzande, Louvain, Bélgica, Págs.: 16 e 17 (1836). FONTENELLE, J.S.E.J. “Manuel Complete du Blanchiment…” Editora Librairie Encyclopédique de Roret, Paris, França (1834), Vol. I, Págs. 42, 48 etc… (1834).
3. ÁGUA DE BROMO:
Logicamente, relacionada à “Água de Cloro”, é uma solução aquosa de outro halogênio, “Água de Bromo”, mais um velho reagente algo esquecido.
História:
O Bromo foi descoberto independentemente, pois dois Químicos, o Francês Antoine Jérôme Balard e o Alemão Carl Jacob Lowig. 1825-1826.
BALARD, A. Ann. Chim. Phys. , Série 2, 32, 337 (1826). BALARD, A. Outro Link. BALARD, A. Ann. Phil. 28, 381 e 411 (1826). LOWIG, C. Mag. Pharm. 21, 31 (1827). LOWIG, C. Ann. Phys. Chem. 14, 485 (1828).
Preparação da Água de Bromo:
A solubilidade do bromo em água foi investigada logo após a descoberta do elemento bromo. SÉRULLAS, M. Phil. Mag. Série 2, 1, 397 (1827). Mas como reagente, corrente no laboratório, água de bromo só surgiria cerca de 50 anos depois. DANCER, W. J. Chem. Soc. 15, 477 (1862). WAAGE, P. Am. J. Pharm. 557 (1871).
Ela é comercial ainda, a 0,25 %, mas hoje é muito pouco usada. Outro reagente esquecido.
E é difícil de ser preparada, devido à muito baixa solubilidade do bromo em água, característica conhecida a muito tempo.
Solubilidade de 2 a 3 % foi reportada (WAAGE, P. Loc. Cit.),mas hoje se sabe, a solubilidade a temperatura ambiente pode ser muito mais baixa, 0,25 %. HIEGEL, G.A. et al. J. Chem. Educ. 64, 156 (1987). Além disso, é muito dependente da temperatura, aquecendo, rapidamente todo o bromo é expulso da solução. RHODES, F.W.; BASCOM, C.H. Ind. Eng. Chem. 19, 480 (1927). A concentração obtida é tão variável que o reagente pode ter cor entre o amarelo pálido e o vermelho.
Para preparar da maneira clássica, você pode agitar água com bromo elementar líquido, Links: 59, 60, 61, ou operar dissolvendo só o vapor do bromo. Links: 56, 57, 58.
Vários autores preferem gerar o bromo “In Situ” , a partir de brometo de sódio ou potássio, e/ou bromatos e hipoclorito, em solução ácida. Links: 62, 63, 64, 65. 66. 81, 82, 83. 84. 85. 86. A grande vantagem é não precisar manipular bromo elementar, bromo líquido.
Meu Método:
Entretanto, meu laboratório é de Síntese Orgânica e Química Preparativa, estamos acostumados a manipular bromo elementar líquido, usado em halogenações.
Por isso, ao preparar a “Água de Bromo“, eu prefiro partir de bromo líquido e aumentar sua solubilidade em água, através da complexação com brometo de sódio ou potássio. Assim se obtém facilmente soluções de concentração constante e mais fácil de conservar.
Eu e meu Orientador de Doutorado, Joseph Miller, elaboramos essa formulação nos anos 80, [FEDERMAN NETO, A.; MILLER, J. (1982)]. Baseados em antigos trabalhos conhecidos de Químicos Inorgânicos. WORLEY, F.P. J. Chem. Soc. Trans. 87, 1197 (1905). JOSEPH, A.F. J. Chem. Soc. Trans. 117, 377 (1920). JONES. G. et al., J. Am. Chem. Soc. 56, 1517 (1934) . BELL, J.M. ; BUCKLEY, M.L. J. Am. Chem. Soc. 34, 14 (1912).
Essa fácil dissolução se baseia na formação dos conhecidos íons complexos com ligação de halogênio, tribrometo. Veja Estrutura.
Referências, tribrometo: GRIFFITH, R.O.; McKEOWN, A.; WINN, A.G. Trans. Faraday Soc.28, 101 (1932). FRASER, T.R.; DOBBIN, L. Earth Env. Scienc. Trans. Roy. Soc. Edin. 37, 1 (1895). LINHART, G.A. J.Am. Chem. Soc. 40. 158 (1918). JOSEPH, A.F.; JINENDRADASA, J.N. J. Chem. Soc. Trans. 99, 274 (1911). LEWIS, G.N.; STORCH, H. J. Am. Chem. Soc. 39, 2544 (1917).
Br2 + NaBr = NaBr3
Br2 + KBr = KBr3
Como manipular bromo líquido e preparar “Água de Bromo”. Meu Método:
O bromo comercial pode vir em frascos mas em geral, vem em ampolas. Links: 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77. 85.

Porém é reagente relativamente caro, mas meu almoxarifado tem bastante.
O bromo é tóxico, corrosivo, irritante e relativamente perigoso. Por isso, procedimentos de segurança são recomendados para sua manipulação. Links: 78, 79. 80.
Esfrie a ampola em geladeira, freezer ou banho de gelo.Quanto mais frio, melhor.
Usando luvas de borracha nitrilica (para química). Ou luva nitrílica descartável, e envolvendo as mãos com um pano, abra a ampola. Para isso, use uma serra para ampolas, lâmina de serra para metal ou uma lima triângulo pequena.
Transfira o conteúdo da ampola, para um frasco limpo e seco, com batoque interno, plástico, feche e guarde, de preferência em geladeira ou freezer.
Na imagem, duas ampolas de bromo, 25 g. cada uma, do meu almoxarifado, marca QEEL, e frasco de vidro com tampa de rosca e batoque interno de polipropileno, marca RBRVidros, Ribeirão Preto, 2020, para armazenar o bromo. As ampolas são antigas, 1990, mas bromo não estraga.

Para preparar a “Água de Bromo”, nosso método:
Reagente usado, por exemplo, em: FEDERMAN NETO ,A.; BORGES, A.D.L; CAMPOS, I.P.; MILLER, J. Synth. React. Inorg. Metalorg. Chem. 27, 1543 (1997).
Nosso método é uma modificação de método clássico, descrito em: MORITA, T.; ASSUMPÇÃO, R.M.V.; DI VITTA, C.; ARAKI, K.; TOMA, H.E.; MASSARO, S. (Revisores), “Manual de Soluções, Reagentes e Solventes.” Editora Blucher, São Paulo, S.P., 2a Edição, Págs. 41, 42 (2009). Edição anterior, Pág 37 (1968). Outro Link. Tenho um exemplar impresso desse excelente livro, e da edição anterior, também. Nós, os Químicos, usamos muito o livro no laboratório.
Excesso de brometo de potássio é usado, para evitar a formação de pentahaletos. Veja: WELLS, H.L.; PENFIELD, S.L. Am. J. Scienc. 43, 17 (1892). WELLS, H.L.; WHEELER, H.L.; PENFIELD, S.L. Am. J. Scienc. 44, 259 (1892). TOWBRIDGE, P.F.; DIEHL, O.C. J. Am. Chem. Soc. 19, 558 (1897).
4. REAGENTE DE NESSLER:
Outro reagente antigo, Reagente de Nessler, para determinação qualitativa e quantitativa de cátions de amônio.
Revisito essa reação, porque embora tenha caído em desuso, o Reagente de Nessler é muito bom, muito sensível e pode detectar pequenas quantidades de amônia ou sais de amônio inclusive em água potável. MENDES, A.T.; PEDROZA, M.M. “Determinação da Concentração de Nitrogênio Amoniacal pelo Método de Nessler.” CONTEC, Congresso Técnico Científico da Engenharia e da Agronomia. Palmas, T.O. (2019). Por isso, eu uso muito.
Na água potável a presença de amônia ou amônio é indesejável e denota poluição dessa água por esgoto.
O reagente foi desenvolvido pelo Químico Alemão Julius Nessler, em sua Tese de Doutorado, 1856.
NESSLER, J. “Uber das Verhalten des Iodquecksilbers und der Quecksilberverbindungen Uberhaupt zu Ammoniak und Uber Eine Reaction auf Ammoniak.” “Tradução Livre do Título: “Sobre o Comportamento dos Compostos Iodomercurados e do Mercúrio, sobre a Amônia e Sobre uma Reação à Amônia.” Dissertação Inaugural (equivale a Tese de Doutorado), Universidade de Freiburg, Alemanha (1856). Outros Links para essa Tese: 87, 88, 89, 90, 91 . Publicação: NESSLER, J. Chem. Zent. Vol. 34, Págs. 527-529, 539-541, 958-962, 969-973, 975-979 (1856).
O Reagente de Nessler é uma solução fortemente alcalina do íon complexo tetraiodomercurato, que com amônia ou sais de amônio, forma um composto de coloração castanha ou marrom, chamado de “Base de Millon“, que tem esse nome devido a ter sido sintetizada pela primeira vez, 1839, pelo Químico Francês Auguste Nicolas Eugène Millon .
Estudo da Reação de Nessler: NICHOLS, M.L.; WILLITS, C.O. J. Am. Chem. Soc. 56, 769 (1934).
HgCl2 + 2 KI = HgI2 + 2 KCl
HgI2 + 2 KI = K2HgI4 em excesso de KOH
NH4+X- (X = contra íon, tipo cloreto) + 2 K2HgI4 + 4 KOH = HgO.Hg(NH2)I + 7KI + 3 H2O + KX
HgO.Hg(NH2)I é o iodeto da “Base de Millon“, cuja estrutura não é totalmente conhecida, mas é considerada polimérica.
Estudos da Base de MIllon: MILLON, E., J. Prakt. Chem. 16, 58 (1839). MILLON, E. J. Prakt. Chem. 37, 117 (1846). INTENSITAT, M. Ann.. Chem. 305, 208 (1899). HOFMANN, K.A.; MARBURG, E.C. Zeit. Anorg. Chem. 23, 126 (1900). PESCI, L. Zeit. Anorg. Chem. 21, 361 (1899). PESCI, L. , outro link. LIPISCOMB, W.N. Acta Cryst. 4, 151 (1951). LIPISCOMP, W.N. Acta Cryst. 4, 266 (1951). NIFSSEN, L.; LIPSCOMP, W.N. Acta Cryst. 7, 106 (1954).
Formulações Modernas do Reagente de Nessler, MORITA, T., et al., Loc. Cit, Pág. 361 (2009). E modificações: YUEN, S.H.; POLLARD, A.G.J. Scienc. Food Agric. 3, 441 (1952). MORRISON, G.R. An. Biochem. 43, 527 (1971). MIDDLETON, K.R. J. App. Chem. 10, 281 (1960). KOCK, F.C.; McMEEKIN, T.L. J. Am. Chem. Soc. 46, 2066 (1924). OLIVEIRA, S.A. Pesq. Agropec. Bras. 16, 645 (1981).
Além da determinação qualitativa da amônia e sais de amônio, o reagente serve para a dosagem quantitativa dos cátions amônio. Para isso, em sua Tese, Nessler desenvolveu uma das primeiras colorimetrias, usando os chamados “Tubos de Nessler“. tubos calibrados de volume idêntico e com marca de enrase, para comparar o padrão e a amostra. Link 92.
Os Tubos de Nessler são um par de tubos, com fundo achatado, calibrados e com rigorosamente o mesmo volume. Assim, volumes iguais de amostra e padrão podem ter sua cor ou turbidez, comparadas. MELLON, M.G. An. Chem. 24, 924 (1952).
Para o leitor ter uma ideia do que é, veja a foto do meu par de Tubos de Nessler.

Tubos de Nessler modernos, existem em forma baixa, ou de forma alta. Modificações de Tubos de Nessler. BRENNEMAN, A.A. J. Am. Chem. Soc. 6, 121 (1884). WATSON, H.J. Am. J. Pharm. 166 (1903). STOKES, A.W. Analyst, 102 (1888). JEONG, H.; PARK, J.; KIM, H. Open Acess J. Chem. 359217 (2013).
Minha Preparação de Reagente de Nessler:
Eu gosto da fórmulação de OLIVEIRA, S.A Loc. Cit. (1981), pois é estável.
Preparar o Iodeto de Mercúrio (II), Adaptado de Química Clássica:
WARINGTON, R., Mem. Chem. Soc. London, 1, 85 (1841), KANE, R. Am. J. Pharm, 3, 252 (1837), BEALE, R.; CHANDLEE, G. Ind. Eng. Chem, An. Ed. 14, 43 (1942), e de: WAGENNECH, F.; JUZA, R., em BRAUER, G. (Editor); REELY, R.F. (Tradutor),”Handbook of Preparative Inorganic Chemistry.” Editora Academic Press, New York, EUA e London, Inglaterra, Vol. 2, Pags. 1110 (no documento digital, 1156) (1965).
Dissolver 10,8 g. (0,04 moles) de Cloreto de Mercúrio (II), em 130 ml de água (usei marca VETEC). Adicione, pouco a pouco, uma solução de 13,6 g. (0.08 moles) de iodeto de potássio (Merck), dissolvidos em 30 ml de água.
O Iodeto de mercúrio (II) se formará, precipitando como um pó de bonita cor verrnelha, viva.

Para não redissolver o precipitado, evite usar excesso de iodeto de potássio.
Complete a reação aquecendo por 2 horas, na temperatura em que começa a sair vapor de agua. Cerca de 80 Cº. Se tiver acesso, pode usar uma estufa. Filtre e lave o precipitado, com água quente e seque ao ar.
Alternativamente, pode usar o iodeto de mercúrio (II) comercial. Link 94. 95. 96. 97. 98. 99. 100.
Para Fazer o Reagente de Nessler. Fórmula adaptada de OLIVEIRA, S.A. (1981).
Suspender 4,6 g de iodeto de mercúrio (II) em 90 ml de água. Juntar 3,5 g de iodeto de potássio, dissolver e juntar aos poucos, para que não aqueça muito, 11,2 g, de hidróxido de potássio.
Deixar a solução esfriar a temperatura ambiente, completar o volume a 100 ml com água desionizada. Deixe em repouso por 24 horas ou mais, decante qualquer sólido que separar, e estoque em um frasco bem fechado.
O reagente se conservará bem por anos. Contudo, não recomendo usar frasco esmerilhado, pois a tampa terá tendência a prender, com esse reagente e com outras soluções fortemente alcalinas.
5. REAGENTE DE MILLON:
Relacionado com a Base de MIllon, outro antigo reagente, descoberto pelo mesmo Químico. o Francês Auguste Nicolas Eugène Millon. Publicação Original do Teste: MILLON, N.E. Lond. Dub. Edin. Phil. Mag. 37, 478 (1850). Primeiro uso eme Medicina: DRUMMOND, J. Montly J. Med. Scienc. 6, 352 (1852).
É um reagente para proteínas solúveis, que detecta a presença, na proteína, do aminoácido Tirosina.
É uma solução de mercúrio metálico em excesso de ácido nítrico, que vai formar o nitrato de mercúrio (II). A reação envolve oxiredução.
3 Hg° + 8 HNO3 = 3 Hg(NO3)2 + 2 NO `+ 4 H2O
Existem variantes modernas que usam sulfato de mercúrio (II) e ácido sulfúrico ou nitrato de mercúrio (II) comercial. Só ou em presença de nitrato de mercúrio (I). Ou adicionam Ágar para formar uma geleia.
O reagente forma um precipitado avermelhado, veja esta imagem e este vídeo.
O complexo é um fenolato de mercúrio (II), formado na recomposição do complexo entre o mercúrio e a Tirosina. KARKI, G. (2018). A estrutura do complexo colorido foi confirmação relativamente recente de Elzagheid. ELZAGHEID, M.I. Mod. Chem. 6, 56 (2018). Mas já haviam propostas de estruturas correlatas.
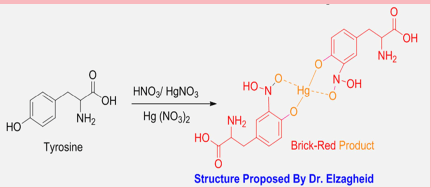
Embora possa ser comprado, foi substituído largamente por reagentes mais modernos, como a Nihidrina. E a “Prova do Biureto“.
6. REAGENTE E REAÇÃO DE BERTHELOT:
Além do Reagente de Nessler, (veja Item 4) há outra reação antiga, mas muito boa, para a identificação qualitativa ou a dosagem da amônia, sais de amônio, ou do amoníaco. RODRIGUES, J. (2017).
Ela é a Reação de Berthelot, do Químico Francês Pierre Eugène Marcellin Berthelot. BERTHELOT, M. Rep. Chim. App. 284 (1859).
Quando inventou, descobriu a reação, Berthelot pensava que anilina se formava do fenol, e pensava que “Violeta de Anilina” era o Corante formado e não o “Azul de Indofenol“. GORDON, S.A.; FLECK, A.; BELL, J. Ann. Clin. Biochem. Int. J. Lab. Med. 15, 270 (1978).
A reação é muito simples de ser executada, até de maneira extemporânea. Adequada até para cursos de Ciências ou Química , inclusive para o Ensino Fundamental ou Médio. Mas é muito interessante também para os Químicos, e apesar de antiga, é muito sensível para amônia e bonita.
Em um tubo de ensaio, coloque alguns cristais de fenol, dissolva em água, adicione amoníaco, amônia aquosa (antigo hidróxido de amônio) e um pouco de hipoclorito de sódio (Água Sanitária) ou hipoclorito de cálcio. Forma-se uma solução do corante Azul de Indofenol,
Observe o “Teste de Berthelot” positivo, que eu executei no laboratório, usando fenol (marca B. Herzog), amoníaco (amônia aquosa) (marca Synth) e hipoclorito de sódio comercial, uma Água Sanitária (marca Aquasan). Desenvolve-se a cor característica do corante Azul de Indofenol.

Como a reação ocorre? A amônia reage com o hipoclorito, formando cloramina, que é eletrófilo forte, e reage com o fenol, um substrato ativado para substituição eletrofílica aromática. O produto halo nitrosado intermediário, após se formar, é uma outra cloramina substituída, que se condensa com outra molécula do fenol,

Outros fenóis, como resorcina, hidroquinona, ácido salicilico, aminosalicilatos, e meio alcalino, dão reações similares ou relacionadas. ROCHA, J.C.; GRANER, C.A.F.; MAGNANI, R. Quím. Nova, 12, 309 (1989). NAING, Z.T.; LIU, Y. (Orientador), “”Ambient Ammonia Analysis Via the Modified Berthelot’s Reaction.” Tese de Mestrado em Ciência Química, California State Polytechnic University, Pomona, Califórnia, EUA (2021).
De fato, “Reagente de Berthelot” moderno, emprega ácido salicílico ou salicilato de sódio (e não o fenol), nitroprussiato de sódio como oxidante em solução alcalina. COGAN, D. et Al. RSC An. Meth. , Accepted Manuscript (2022).
Há modificações e sabe-se que a reação é melhorada pela presença de oxidantes como cloreto de cobre (II), CuCl2, ou nitroprussiato de sódio, Na2[NO(CN)5], outro link.
7. REAGENTE DE TOLLENS:
Mais um reagente algo esquecido…. “Reagente de Tollens“, para Formol e outros aldeídos e para acúcares com grupo aldeído, RCHO (Aldoses). Dão reação positiva também as α-hidroxi cetonas.
O reagente foi descoberto, inventado, pelo Químico Alemão Bernhard Christian Gottfried Tollens . TOLLENS, B. Ber. Dtsch. Chem. Gessel. 15, 1635 (1882) . Link para o Artigo completo.
Ele consiste em uma solução aquosa contendo o cátion complexo diaminprata, preparada com nitrato de prata, amônia aquosa (amoníaco) e hidróxido de sódio. PINTO, G.; MARTIN, M.; HERNÁNDEZ. J.M.;MARTIN, M.T. An. Quím. Espanha 111, 173 (2015) . Outro link. BENET, W.E.; LEWIS, G.S.; YANG, L.Z.; HUGUES, P.E. J. Chem. Res. 575 (2011). COELHO, P. (2012).
2 AgNO3 + 2 NaOH = Ag2O + 2 NaNO3 + H2O
Ag2O + 4 NH3 + H2O (antigo NH4OH) = 2 [Ag(NH3)2]OH
NaOH estabiliza o complexo. GUNAWARDENA, G. (2020).
Preparação moderna do reagente de Tollens. Consulte os links: Vedantu, Protonstalk, Tollen’s Reagent, Tollen Reagent. COELHO, P. (2012). SARAN, L.M. (2022). LEITE, G. (2016). NCSU Chemistry Dept., Aakash, Ìndia. RODRIGUES, J. (2014). StringFixer. Infopedia, Portugal. Universidade Federal do ABC (2011).
Uma modificação do reagente emprega nitrato de amônio, no lugar do hidróxido de sódio. Outra variante adiciona a amônia antes e substitui o hidróxido de sódio pelo de potássio. Mais uma variante prepara o reagente a partir de nitrato de prata 5 %.
ARTIGO EM EXPANSÃO.

