
Autoria: Alberto Federman Neto, AFNTECH.
Revisto, ampliado e atualizado em 10 de Dezembro de 2021.
Este artigo reporta e revisa meus atuais estudos correntes sobre o 1-fluoronaftaleno e outros compostos de reatividade relacionada, correlata.
In Memoriam de Meu Orientador de Doutorado, Prof. Dr. Joseph Miller, que acreditando em mim, me ensinou muito e guiou meus passos iniciais na caminhada da Ciência, a muitos anos atrás. Sempre me lembrarei, e sempre serei grato a ele. Saudades, Mestre!
Incluindo dados de meus estudos de nitração do naftaleno.
1. INTRODUÇÃO:
Dentro da Química, minha especialidade é Síntese Orgânica, especialmente de derivados aromáticos, e Química e Síntese Organometálica de compostos orgânicos aromáticos contendo metais de transição.
O 1-fluoronaftaleno (alfa-fluoronaftaleno) é um líquido volátil e de odor característico. Estrutura 3D.
Me interessei por ele, porque é uma forma reativa (para Substituição Nucleofílica Aromática) de anel de naftaleno, usado para introduzir um fragmento de naftaleno em certos fármacos, em especial os derivados da Fluoxetina, Prozac®.
Referências: LABIDI, A. “Duloxetine Synthesis” (2021) . GANÉO NETO, L.; MILAGRE, H.M.S. (Orientador). “Pílula da Felicidade. Síntese e Legado da Fluoxetina.” TCC, Trabalho de Conclusão de Curso Para Obtenção de Grau de Bacharel em Química, Instituto de Química, Universidade Estadual Paulista Júlio de Mesquita Filho, Araraquara, S.P. (2021). PEREIRA, R.S. Quím. Nova, 20, 551 (1997).
Substituição Nucleofílica Aromática, era especialidade do meu Orientador, Prof. Dr. Joseph Miller, e importante também no meu desenvolvimento científico e técnico. SMITH, D.M. Nature 223, 427 (1969). MILLER, J., “Reaction Mechanisms in Organic Chemistry. Aromatic Nucleophilic Substitution.” Editora Elsevier, Londres, Inglaterra (1968). Outro Link para o livro. Também pode baixar daqui. GOMES, P.C.B.; VICHI, E.J.S.; MORAN, P.J.S.; FEDERMAN NETO, A.; MAROSO, M.L.; MILLER, J. Organometallics, 14-15, 3198 (1996).
Embora 1-fluoronaftaleno seja comercial, produzido por exemplo, na China, e nos EUA, não é achado com facilidade no Brasil. Apenas se encontram o 1-cloronaftaleno e 1-bromonaftaleno.
Que também são muito mais fáceis de preparar, por reações clássicas de Gattermann ou de Sandmeyer, descobertas pelos Químicos, o Engenheiro de Precisão e Químico autodidata Suiço Traugott Sandmeyer e o Alemão Ludwig Gattermann, e extensamente descritas em muitos sites e livros de Química Orgânica Experimental. SANDMEYER, T. Ber. Dtsch. Chem. Gessel. 17, 1633 (1884). SANDMEYER, T. Ber. Dtsch. Chem., Gessel. 17, 2650 (1884). Veja GATTERMANN, citado no artigo: HODGSON, H.H. Chem. Rev. 40, 251 (1947). GATTERMANN, L. Ber. Dtsch. Chem. Gessel. 23, 1218 (1890).
Reações de Sandmeyer modificadas para obter compostos organometálicos e organosemimetálicos de boro, fósforo e estanho. MO, F. et al. Acc. Chem. Res. 51, 496 (2018) .
Em contraste com os derivados de benzeno, as estruturas dos derivados do naftaleno (naftalina) eram muito menos conhecidas, e objeto de controvérsia, até antes da metade do século XX. HARRISON, W.A. “Some Empirical Rules Concerning Sustitution in the Naphtalene Nucleous.” Tese de Doutorado, Ph.D., Victoria University, Manchester, Inglaterra (1925). NAKATA, N. Bull. Chem. Soc. Japan 10, 318 (1935). BERGMANN, E.; HIRSHBERG, J. J. Chem. Soc. 331 (1936).
2. BALZ-SCHIEMANN, REVISÃO, E SÍNTESES CONHECIDAS DO 1-FLUORONAFTALENO E COMPOSTOS RELACIONADOS:
O naftaleno é um hicrocarboneto aromático, formado por dois anéis de benzeno...
Aceita-se que o benzeno foi descoberto oficialmente pelo Físico e Químico Michael Faraday, em 1825. FARADAY. M. Phil. Trans. Roy. Soc. London 115, 440 (1825). Outro Link. TRIPP, E.H. Nature, 115, 909 (1925). FARADAY, M. Nature, 115, 1001 (1925).
Mas teria sido observado e descoberto cerca de 40 anos antes. SCHELENZ, H. Angew. Chem. 21, 2577 (1908). TRIPP, E.H. Loc. Cit. . De fato, a porção volátil do alcatrão da hulha, que conteria o benzol, benzeno, é citada em livros antigos, de 1740-1789. Por isso, possível que tenha sido descoberto antes.
De fato , já era citada a destilação da hulha, pelo Farmacêutico Francês Jacques François Demachy e pelo famoso e importantíssimo Químico Francês Pierre Joseph Macquer
NEUMANN, C. “Praelectiones Chemicae;”, Editora Johann Andreas Rúbiger, Berlim, Alemanha (1740). MACQUER, P.J. ; SCOPOLI, G.A. (Tradutor), “Dizionario di Chimica.” Editora: Stamperia del Monastero, Pavia, Itália (1783). MACQUER, P.J.; LEOBARBI, J.G. (Editor) “Chymisches Wortenbuch.” Tradução Livre do Título: “Dicionário de Química.” Editora: Weidmann, Leipzig, Alemanha (1789). DEMACHY, J.F.; HAHNEMANN, S. (Tradutor) “Laborant…” Leipzig, Alemanha (1784). Outra edição de (1784). MACQUER, P.J. “Dictionnaire de Chemie.” Editora Lacombe, Paris, França, Vol. 1 e Vol 2 (1766).
O naftaleno foi isolado a muito tempo, em 1820. KIDD, J. Phil. Trans. Roy. Soc. London, 111, 209 (1821). Estudado por Michael Faraday, que descobriu sua fórmula. FARADAY, M, Phil. Trans Roy. Soc. London 116, 140 (1826). Estrutura determinada pelo Químico Alemão Richard August Carl Emil Erlenmeyer. ERLENMEYER, M. Ann. Chem. 137, 1866 (1866).
Cloro e Bromo Naftalenos eram conhecidos a bastante tempo. MELDOLA, R. J. Chem.Soc. Trans. 47 , 497 (1885).
O 1-fluoronaftaleno foi observado apenas com rendimento baixo, pela reação do sal de diazônio do naftaleno com ácido fluorídrico, por Wilke-Dortfurt e Balz em 1927. WILKE-DORTFURT, E.; BALZ, G. Ber. Dtsch. Chem. Gessel 60 , 115 (1927). Mas foi preparado com bons resultados, em 1931, por Schiemann. SCHIEMANN, G.; GUEFFROY, W.; WINKELMULLER, W. Ann. Chem. 487, 270 (1931).
O primeiro método prático para sua obtenção, foi por pirólise seca do tetrafluorborato de 1-naftildiazônio, método geral descrito em 1927, na reação hoje chamada de Balz-Schiemann. Descoberta pelos Químicos Alemães Gunther Balz e Gunther Schiemann.

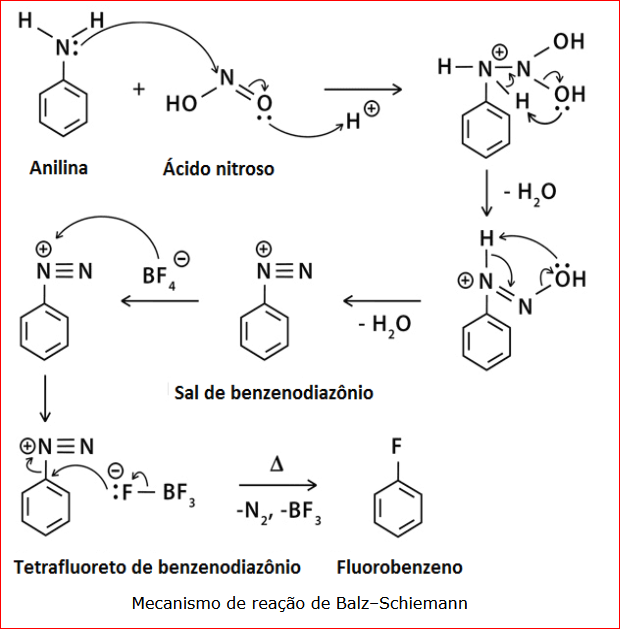
Outros métodos são mais complexos. BOECHAT, N.; PINTO, A.C.; BASTOS, M.M. Quím Nova 38, 1323 (2015). Link 1. Link 16.
Referências : BALZ, G.; SCHIEMANN, G. Ber. Dtsch. Chem. Gessel. 60, 1186 (1927). BEATY, R.D.; MUSGRAVE, W.K.R. (Orientador) “The Introduction of Fluorine into Organic Compounds.” Tese de Doutorado em Filosofia, Modalidade Ciências Naturais, Universidade de Durham, Durham, Inglaterra (1951). ROE, A. Org. React. V, 193 (1949). Link 2. FLOOD, D.T. Org. Syn. 13, 52 (1933). SCHIEMANN, G.; WINKELMULLER, W.; HARTMAN, W.W.; BYERS, J.R.; DICKEY, J.B. Org. Syn. 13, 52 (1933). Shanghai Kangpeng Science and Technology Co., Ltd. , Patente Chinesa CN1887833A (2007). ZHEJIANG YONGTAI TECHNOLOGY Co. Ltd. Patente Chinesa, CN102557865B (2014). MO, F. et al. Org. Biomol. Chem. 11, 1582 (2013).
Revisões, “Reviews” da Reação de Balz-Schiemann e reações relacionadas: CRESSWELL, A.J.; DAVIES, S.G.; ROBERTS, P.M.; THOMSON, J.E. Chem. Rev. 115, 566 (2014). ROE, A. Org. React. 5, 193 (1949). Livros, vários.
A vantagem principal é a obtenção fácil dos precursores, pela diazotação direta das aminas comerciais ou facilmente obtidas. Os sais de diazônio foram descobertos pelo Químico Industrial Alemão Johann Peter Griess, em 1858. GRIESS, J.P. Phil. Trans. Roy. Soc. London 154, 667 (1864). GRIESS, J.P. Proc. Roy. Soc. London 13, 375 (1864). GRIESS, P. Ann. Chem. 106, 123 (1858). HEINES, S.V. J. Chem. Educ. 35, 187 (1958).
Os procedimentos experimentais, de laboratório, para fazer os tetrafluorboratos de diazônio e sua conversão em flúor derivados, foram revisados em um antigo, mas ótimo e clássico artigo de Roe. ROE, A. Org. React. 5, 193 (1949).
Ocorre que a reação de Balz-Schiemann frequentemente dá rendimento baixo, forma subprodutos e pode ser perigosa, porque envolve aquecimento de um sal de diazônio potencialmente explosivo, no estado sólido. As vezes se usam, invés de tetrafluoroboratos, hexafluorofosfatos de diazônio, muito menos solúveis. link 5. link 7.
Sempre se usava, link 4, a pirólise seca, pois os sais de diazônio aquosos, não perigosos e não isolados (embora muito usados em síntese orgânica), links 6, 7, sempre produzem fenóis ou produtos de acoplamento arílico, invés dos flúor derivados esperados.
Para formar aromáticos derivados do bifenilo, a reação de acoplamento, inclusive tem um nome especial. Acoplamento de Gomberg-Bachmann.
Para minimizar esses inconvenientes, métodos foram descritos para fazer a reação de Balz-Schiemann em solventes não aquosos. Como por exemplo, fazer a decomposição do sal de diazônio em THF, tetraidrofurano, FLETCHER, T.; NAMKUNG, M. Chem. Ind. 179 (1961). DEWAR, M.J.S.; MICHL, J. Tetrahedron, 26, 375 (1970). Ou em solvente apolar, éter de petróleo.
YANG e ZHANG, loc. cit., abaixo, reportam que solventes pouco polares como clorobenzeno, ou apolares, como hexano, dão melhores resultados na reação tipo Balz-Schiemann, seja ela térmica ou fotoquímica.
Também se pode decompor o sal de diazônio com pouco aquecimento, por exemplo com trifluoreto de boro eterato, 11, com HF-piridina, líquidos iônicos e outros reagentes. Em líquidos iônicos. Links 8. 9. 10. 15. Revisão.
Merece citação o antigo procedimento, nos dias atuais, clássico, de decompor os tetrafluorboratos de diazônio com pó de cobre, em solução de acetona. BERGMANN, E.D.; BERKOVIC, S.; IKAN, R. J. Am. Chem. Soc. 78, 6037 (1956). O procedimento é considerado difícil de ser usado, por SUSCHITZKY et al., loc. cit.
De fato eu, em meu Mestrado, tentei usar o método de Bergmann, para fazer fluorobenzeno, a partir de anilina diazotada em ácido clorídrico, e precipitação com tetrafluoroborato de potássio, e só obtinha clorobenzeno e bifenilo.
De fato, o procedimento é considerado de difícil reprodutibilidade. KOBARFARD, F.; KAUFMANN, J.M.; BOYKO, W.J. J. Het. Chem. 36, 1247 (1999). WULFMAN, D.S.; PATAI, S. (Editor), “Diazonium and Diazo Groups. Synthetic Applications of Diazonium Salts.” Editora Wiley, Part 1, Vol. 1 (1978).
Decompor o sal de diazônio com luz visível ou ultravioleta, sem aquecer. “Foto Balz-Schiemann“. YANG, L.; ZHANG, C.P. ACS Omega, 6, 21595 (2021). PETTERSON, R.C. et al. J. Org. Chem. 36, 631 (1971) .YANG, L.; ZHANG, C.P. Asian J. Chem. 10, 157 (2021). LIU, J. et al. J. Flow Chem. 10, 589 (2020).
Excelente artigo sobre as modificações de Balz-Schiemann. SUSCHITZKY, H.; WAKEFIELD, B.J. “Aromatic Fluorine Chemistry at the Millenium. Aromatic Fluorine Chemistry ant Salford“, Cap. 26, de livro, pag. 463 (2000).
Métodos novos para fazer fluoretos aromáticos, incluem desaminação direta da amina do naftaleno, mediada por cobre. PÉREZ-GARCIA, R.M. et al. Org. Lett. 23, 1011 (2021). Modificação química de vários naftalenos halogenados. Fluoração direta do naftaleno, com reagentes pouco usuais. Fluoração do Reagente de Grignard do naftaleno. Fluoração com hipofluorito, ou com espécies de iodo(III) hipervalente. fluoro desaminação com sal de diazônio em meio orgânico, feito com nitrito de terciobutila. ou com fluorborato de nitrosilo.
Também eventualmente pode ser usado, invés de diazônio, deslocamento nucleofílico de bromonaftalenos ou cloronaftalenos, por fluoretos de potássio ou prata, catalisadores de cobre ou níquel, ou paládio. Link 12, 13.
O protótipo desse tipo de Química, transformar cloretos e brometos reativos, em iodetos ou fluoretos, eu já fiz, se chama “Reação de Finkelstein“, Links: 14, 15, 16, 17, 18, 19, 20, 21. Essa reação foi descoberta pelo Químico Alemão Hans Finkelstein, em 1910. FINKELSTEIN, H. Ber. Dtsch. Chem. Gesell.,43, 1528 (1910).
Correlacionada é a reação de Swarts, mas esta combina substituição nucleofílica aromática tipo Finkelstein, com fluoração direta oxidativa por fluoreto de antimônio., Fluoração de Swarts. Link detalhado, mas em Alemão. Descoberta pelo Médico e Químico Belga Frédéric Jean Edmond Swarts. SWARTS, F. Bull, Acad. Scienc. Belg. 3, Ser (4). 474 (1892). BOECHAT, N.; PINTO, A.C.; BASTOS, M.M. Quím. Nova, 38, 1323 (2015).
Também relacionada à Reação de Finkelstein, é o processo industrial de troca de haleto, Processo HALEX, “Halogen Exchange” . FERREIRA, A.L.G.; SALVADOR, J.A.L. (Orientador) “Novos Processos de Fluoração em Química Farmacêutica Industrial.” Dissertação de Mestrado em Química Farmacêutica Industrial, Faculdade de Farmácia, Universidade de Coimbra, Coimbra, Portugal (2013).
O Processo HALEX, envolve uma troca de halogênio, link 22, 23, similar à reação Finkelstein, mas industrial e podendo ser regioseletiva. Foi inventada pelo Químico Alemão Hans Billroth Gottlieb , em 1936. GOTTLIEB, H.B. J. Am. Chem. Soc. 58, 532 (1936). OKAZOE, T. Proc. Jpn. Acad. Ser. B, 85, 276 (2009). Link 24.
Uma representação do processo HALEX, Uma Síntese do 2,4-dinitrofluorbenzeno, por troca Cl por F, em 2,4-dinitroclorobenzeno. O derivado fluorado é chamado “Reagente de Sanger“ e é usado em sequenciamento de proteínas e ácidos nucleicos. Desenvolvido pelo Bioquímico Inglês Frederick Sanger. SANGER, F. Biochem. J. 39, 507 (1945).

3. PLANEJAMENTO DOS EXPERIMENTOS:
Planejamento dos experimentos a serem feitos.
O intermediário chave a ser utilizado nos meus experimentos será a 1-naftilamina, alfa naftilamina. Ela pode ser comprada. Links: 22, 23, 24, 25, 26. 27, 28, 29, 30. Disponível como base livre ou como cloridrato.
Mas se não quiser comprar, ela pode ser preparada facilmente o material de partida é o naftaleno, puro, Links: 31, 32, 33, 34, 35 .
Ou mesmo, usar o produto industrial ou de pureza técnica, link 36, bastante puro para ser usado nestes experimentos. Sim, são as populares “bolinhas de naftalina”, que vc acha até em algumas mercearias e mercadinhos. Links: 36, 37, 38, 39, 40.
Na primeira reação, primeira etapa, você deve moer as bolinhas de naftalina, o quanto for usar. e fazer uma nitração dela, para formar 1-nitronaftaleno, alfa nitronaftaleno.
A nitração do naftaleno já era bem conhecida e tinha já importância industrial em 1866. WATTS, H. “A Dictionary of Chemistry.” Longmans Green, Londres, Inglaterra, Vol. 4, Págs 5 e 20 (1866).
A nitração pode utilizar vários reagentes nitrantes comuns e convencionais. OLAH, G.A.; NARANG, S.C.; OLAH, J.A. Proc. Natl. Acad. Scienc. 78, 3298 (1981). Pode-se sulfonar o naftaleno e depois adicionar ácido nítrico. KRUK, W.H; BLOMEM, J.E J. Am. Chem. Soc. 19, 532 (1897). Particularmente convenientes são as nitrações de naftaleno em anidrido acético, em ácido acético e em 1,4-dioxano. KHABAROV, Y.G. et al. (2019). Revisão da reação de nitração. PATEL, S.S.; PATEL, D.B.; PATEL, H.D. Chem. Sel. 6, 1337 (2021).
Há dois procedimentos simples, publicados na Internet, para fazer a nitração do naftaleno. PREP CHEM. E Chegg.
Eu fiz nitração de naftaleno de maneira clássica, muitas vezes, por muitos anos, desde o colégio técnico, pois usava nitronaftalenos como intermediários químicos. Procedimentos conhecidos e publicados para nitrar o naftaleno. Links: 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65. 70. 71, 72. 73.
Se desejar fazer a nitração de maneira clássica, como eu sempre fiz, você pode seguir o protocolo dado em muitos livros texto de Química Orgânica Experimental.
Em particular no conhecidíssimo “Livro do Vogel“. Eu tenho impressas, 3 edições. Acessível online. VOGEL, A.I. (Autor); FURNISS, B.S.; HANNAFORD, A.J.; SMITH, P.W.G.; TATCHELL, A.R. (Revisores), “Vogel’s Textbook of Practical Organic Chemistry.” Editora: Longman Scientific & Technical, Harlow, Inglaterra, 5a Edição, Pág 855 (1989). Link 66. 67. 68. 69. 70.
A nitração forma, em geral, o 1-nitronaftaleno, como esperado, pois o intermediário reativo do ataque do cátion nitrônio na posição um é mais estável. Mas um pouco de 2-nitronaftaleno, pode ser formar, pela posição 2 ser menos estéricamente impedida.
Na etapa seguinte, vamos reduzir o 1-nitronaftaleno, produzindo a 1-naftilamina, alfa naftilamina. A substância foi descoberta pelo Químico Russo Nikolay Nikolaevich Zinin, em 1842. ZININ, N.Z. Ann. Chem., 44, 283 (1842).
Foi ele também quem inventou a nitração hoje clássica, com mistura sulfonítrica, ácido sulfúrico com ácido nítrico (até essa época, nitrações eram feitas só com ácido nítrico) . ZININ, N.Z. J. Prakt. Chem. 27, 140 (1842), Mas na História da Nitração, merecem destaque também os trabalhos pioneiros do Francês Théophile Jules Pelouze e do Suiço Christian Friedrich Schönbein.
Uma outra maneira de obter a 1-naftilamina, precursora do 1-fluoronaftaleno, é partir não do naftaleno, mas do 1-naftol. Alfa naftol. Matéria prima para fazer corantes e que pode ser comprada.
O 1-naftol pode ser transformado na 1-naftilamina através de uma reação reversível com amônia e sulfito de sódio, bissulfito ou metabissulfito. Chamada “Reação de Bucherer“. Fonte da Imagem: nptel.ac.in , Índia:
A reação foi inicialmente patenteada pelo Químico Francês R. Lepetit, tal como citado em: FRIEDLANDER, P. Ber. Dtsch. Chem. Gessel. Series A & B, 54, 620 (1921). Mas foi aperfeiçoada pelo Químico Alemão Hans Theodor Bucherer. BUCHERER, H.T, J. Prakt. Chem. 69, 49 (1904). Trabalho completo. Revisões da Reação: SEEBOTH, H.. Angew. Chem. Int. Ed. 6, 307 (1967). DRAKE, N.L. Org. React. 1, 63 (2004). Outro Link. Procedimento em microondas: CANETTE, A. et al. Synth. Comm. 31, 2143 (2001).
4. RESUMO E CONCLUSÕES :
As sínteses dos compostos aromáticos organofluorados foi revisada, com ênfase na preparação do 1-fluoronaftaleno, por reação clássica de Balz-Schiemann, suas modificações, e outros métodos relacionados.
Observação: As várias referências bibliográficas citadas neste trabalho, foram obtidas pelos métodos gerais publicados neste artigo.


