
Autoria: Alberto Federman Neto, AFNTECH.
Revisto e Ampliado em: 16 de Novembro de 2023.
1. INTRODUÇÃO:
Neste Artigo, reagentes precipitantes para potássio, sódio e outros metais alcalinos: Lítio rubídio e césio.
A imagem que ilustra este artigo: São tubos de ensaio contendo soluções de sais coloridos, de metais de transição. Fonte da imagem: Depositphotos, foto feita pela usuária Belchonock (2011).
Muitos sais insolúveis ou pouco solúveis, de metais alcalinoterrosos ou de transição, são conhecidos. Assim se torna fácil precipitá-los. Exemplos o sulfato de bário, BaSO4, o Carbonato de cálcio, CaCO3. Oxalato de cálcio, CaC2O4, carbonato básico de cobre, fosfato de cobalto, óxidos e carbonatos de prata e mercúrio etc…
Em contraste, a maioria dos sais de amônio ou dos metais alcalinos, como sódio, potássio, lítio, são solúveis, o que dificulta sua precipitação e reações de identificação química qualitativa.
Vamos ver neste artigo, o que nós os Químicos, podemos fazer e usar para precipitar o amônio e os metais alcalinos. Como em outros artigos neste Blog, ressalto a História da Química desses reagentes.
Além disso o Artigo contém o balanceamento novo, de uma reação antiga , mas pouco conhecida, a oxidação de antimônio (III) a antimônio (V), por água oxigenada em presença de oxigênio do ar. Veja Item 7, Sub-item 7b, “Piroantimoniato de Potássio”.
2. PRECIPITANTES PARA POTÁSSIO:
2a, 2b, 2c -Picrato, Tetrafenilborato ou Perclorato:
Mais fácil, pois para precipitar e identificar os sais de potássio, até que existem alguns reagentes fáceis de se conseguir.
Como mostrei em artigo anterior, você pode usar o ácido pícrico [precipitado de picrato de potássio, C6H2(NO2)3OK]
Também o tetrafenilborato de sódio , que pode ser comprado, embora caro, precipita um tetrafenilborato de potássio insolúvel. KB(Ph)4.
Usando uma solução aquosa concentrada de ácido perclórico ou de perclorato de sódio, reagindo com sais de potássio, obtêm-se precipitado de perclorato de potássio, KClO4, pouco solúvel. Qualquer perclorato de sódio que reste na solução, pode ser separado por extração com álcool (este remove só o perclorato de sódio).
2d. Cobaltinitrito de Sódio:
História Resumida do Cobalto, Seus Esmaltes Azuis e seus Compostos:
Sais de cobalto já eram conhecidos dos Químicos Antigos. WALTIRE, J. (Autor e Editor) “Consise Essays Upon Various Philosophical and Chemical Subjects. Tables of Various Combinations and Specific Attraction of the Substances Employed in Chemistry.” Londres, Inglaterra (1759).
Os minérios de cobalto foram estudados por volta de 1702, pela Alquimista Alemã Dorothea Juliana Wallich . KRAFT, A. (2019). Outro Link
Ela influenciou o Filósofo, Alquimista e Professor Alemão Karl Christoph Schmieder . que divulgou seu trabalho e a tornou conhecida. Os minérios de cobalto tinham usos técnicos, mas sua composição não era conhecida.
O termocromismo do cobalto foi notado por Wallich, Que descreveu as cores verde, rosa, azul e azul violeta para os compostos do cobalto. WALLICH, D.J. (ou pseudônimo D.IV.V) “Das Mineralische Gluten, Doppelter Schalangen-Stab, Mercurious Philosophorum…..” Tradução Automática e Livre do Texto, em Alemão e Latim: “O Glúten Mineral, A Vareta com a Crosta Dupla do Mercúrio Filosófico…..” Escrito em Weimar, Alemanha e Zurique, Suiça. Editado em Leipzig, Alemanha, Pág 26 (1705) .
Mas o cobalto foi “descoberto oficialmente”, como um elemento químico, pelo Alquimista, Químico e Mineralogista Sueco Georg Brandt. Mas ele supunha que se tratasse de um semimetal, metalóide, o Bismuto. Mas termina por separar o Cobalto do Bismuto. Brandt é também o descobridor dos semimetais.
WALLERIUS, J.G.; “Minerálogie. Description Généralle des Substances di Regne Mineral.” Editora e Tradutora do Alemão, Durant & Pissot, Paris, França, Vol. 1, Págs XIX e várias outras (1753). BRANDT, G. Acta Literaria et Scientiarum Sveciae, “Dissertatio de Semimettalis.”,Suécia, (1735). Citado por FORS, H, Osiris, 29, 230 (2014). E JOHANSON, P. “Cobalt.” Editora Rosen Publishing Group, New York, EUA. (2008).
Um excelente reagente (eu gosto) para precipitar potássio é o cobaltinitrito de sódio, hexanitrocobaltato de sódio. Na3[Co(NO2)3]. O potássio precipita como sal ou como sal duplo de sódio:
Na3[Co(NO2)6] + 3 KCl = K3[Co(NO2)6] + 3 NaCl OU
Na3[Co(NO2)6] + 2 KCl + H2O = K2Na[Co(NO2)6].H2O + 2 NaCl
Descoberto pelo Químico Alemão N.W. Fischer , em 1848, FISCHER, N.W. Ann. Phys. 150, 115 (1848). tal como citado em: ROSENHEIM, A.; KOPPEL, I. Zeit. Anorg. Chem. 17, 35 (1898), e em química moderna citado, por: CARUNCHIO, V.; GERARDI, N.A. J. Chrom. 31, 653 (1967).Veja também KAMM, O.; BURGESS, L.L. (Orientador) “Study of Cobaltinitrites and Their…..” Tese de Mestrado em Ciência Química, Escola de Graduação da Universidade de Illinois, Chicago, Illinois, EUA (1913).
Estudado por Erdmann. ERDMANN, O.L. J. Prakt. Chem.97, 385 (1866) . E outros.
Protocolos experimentais para a preparação e uso do reagente cobaltinitrito, foram desenvolvidos, eram bons e por isso, depois se tornaram muito clássicos. KENYON, C.; OVENSTON, C.J.; PARKER, C.A. Analyst, 75, 269 (1950).
Protocolos de Koninck e de Billmann. DE KONINCK, L. Ber. Dtsch, Chem., Gessel. 14, 2121 (1881) . Outro Link. 22. DE KONINCK, L.L. Zeit An. Chem. 20 , 390 (1881). BILLMANN, E. Zeit. An. Chem. 39, 284 (1900). O mesmo Químico, Billmann, o adaptou posteriormente para determinar potássio em plantas e tecidos biológicos, tal como citado em: MACALLUM, A.B. Ergeb. Physiol. 7, 552 (1908).
Você pode comprar esse composto. Links: 8, 9, 10. Mas se desejar prepará-lo, não é difícil.
Durante minha prática de anos, com Química, tentei obtê-lo do cloreto de cobalto (II), o mais comum sal de cobalto para comprar. Isso foi tentado e é descrito, desde 1967, mas nunca consegui obtê-lo puro, partindo direto desse sal, o cloreto. FEDERMAN NETO (1975).
Se quiser obter o reagente, sem isolar, líquido e em solução, para diretamente precipitar potássio, você pode partir de acetato de cobalto, feito como resumi neste artigo. E veja: ADIE, R.H.; WOOD, T.B. J. Chem. Soc. Trans.77, 1076 (1900). BASKERVILLE, C.; HARRIS, I.F. Journal of the Elisha Mitchell Scientific Society 17, 18 (1900). Link 12.
Ou até do nitrato de cobalto. Especialmente prático é protocolo descrito por MATOS, J. (2020).
Protocolos para preparar a solução, também estão descritos em um clássico e importante livro: MORITA, T.; ASSUMPÇÃO, R.M.V. “Manual de Soluções, Reagentes e Solventes.” Editora Blucher, São Paulo, S.P., 2a Ed., 2a Reimp. Pág. 167 (2009). Tenho uma cópia impressa, e da primeira edição, também.
Cumpre notar que em algumas edições, o composto está grifado no livro, com o nome errado: “Hexanitrocobaltito” de sódio, o correto seria dizer: “Hexanitrocobaltato“, pois é cobalto (III), e não cobalto (II). “Cobaltinitrito de Sódio”. Na3[Co(NO2)6]
Se quiser obter o reagente sólido e puro, é melhor partir do nitrato de cobalto (II). LInk: 29, 38, BRAUER, G.; RILEY, R.F. (Tradutor) “Preparative Inorganic Chemistry.” Academic Press, New York, EUA, Vol. 1 , Pág 1541 (1963). ALBERT, P. (2009). CLARK, J. (2003-2015) Veja também várias referências em 13. A síntese dos cobaltinitritos de sódio e potássio, sólidos, foi otimizada por: VENDILO, A.G. Et Al. Russ. J. Inorg. Chem. 56, 501 (2011).
Pode-se usar o nitrato de cobalto, obtido do cloreto, mais fácil de achar no comércio. ALBERT, P. (2009). CLARK, J. (2003-2015). Ou use meu método modificado. Combinei um antigo procedimento meu, FEDERMAN NETO, A. (2012), com os métodos de CLARK e ALBERT, Loc. Cit.
Preparação Simples de Cobaltinitrito de Sódio em Laboratório:
Para precipitar o precursor insolúvel de cobalto, a anos, (FEDERMAN NETO, A. 2012), substituí o uso do carbonato , ou o hidróxido de sódio, precipitantes usados por outros autores, incluindo os acima citados, por uma quantidade estequiométrica calculada de amônia aquosa (amoníaco). Veja: RAJAMATHI, M., Et Al. Mat. Res. Bull. 35, 271 (2000). RAMESH, T.N Et Al. Solid State Scienc. 5, 751 (2003).
Uso do carbonato de cobalto ou do hidróxido, como intermediários. CUNNINGHAM, M.; PERKIN, F.M. J. Chem. Soc., Trans. 95, 1562 (1909). BRAUER & RILEY, Loc. Cit, Págs. 1520, 1566, 1567, 1568, 1576, 1578, 1581, (1963).
Meu método evita impurezas de cloreto de sódio (mais difícil de lavar), formando apenas cloreto de amônio, fácil de remover, ou nitrato de amônio, decomponível com calor, sem deixar resíduo.
Além disso, esses sais são floculantes, ANDRADE, J.C.; ALVIM, T.R. Chemkeys, 0, 1 (2009). O que facilita a precipitação do hidróxido de cobalto intermediário.
Cloreto de cobalto pode ser comprado, links 13, 14, 15. O nitrato é muito menos comum. 16.
Pesar 23,8 g. (0,1 mol) de cloreto de cobalto hexahidratado (no meu teste, usei o P.A. de marca Vetec), em 50-70 ml de água. Adicionar pouco a pouco, cerca de 14 ml (0,2 mol) de amoníaco, (antigo hidróxido de amônio 28 %). Veja links: 17, 18.
Importante evitar excesso de amoníaco, ou haverá solubilização do sólido, formando amino complexos de cobalto. GUNN, E. (2015).
Forma-se um precipitado de hidróxido de cobalto, podendo ser de cor rosa escura. mas podendo ser azul, ou esverdeado, se contiver sal básico, ou cloreto coordenado. Consulte estes links para ver os vários sais básicos de cobalto, de cores diferentes, e que podem se formar. Links: 19, 20, 21, 22,
Filtre o sólido e lave bem com água desionizada. Não é necessário secar. Suspenda o sólido em 25-30 ml de água, e adicione, aos poucos, cerca de 13 ml de ácido nítrico concentrado. Isso vai dissolver o hidróxido de cobalto, formando uma solução vermelha de nitrato de cobalto (II).
Observação: Desejando preparar e isolar o nitrato de cobalto, neste ponto, interrompa o experimento e faça uma evaporação cuidadosa.
Para fazer hexanitrocobaltato de sódio. Dissolver excesso, 30 g de nitrito de sódio em 40-50 ml água. adicionar o nitrato de cobalto (II), e 7-10 ml de ácido acético.
Neste ponto, a oxidação a cobalto (III) pode ser feita de maneira usual, soprando ar, vários links, ou por adição gota a gota de água oxigenada concentrada, peróxido de hidrogênio 30 %. O cobaltinitrito de sódio é isolado por precipitação com álcool.
Assim o hidróxido de cobalto pode ser formado sem formar grande quantidade de cloreto de sódio, a ser eliminada.
Reações que ocorrem, no meu procedimento:
CoCl2.6H2O + 2 NH4OH (eq. a 2NH3 + 2H2O) = Co(OH)2 + 2 NH4Cl (evita os íons de Na)
NH4Cl muito solúvel (facilita a lavagem)
Possível resíduo de NH4NO3 dec. calor = N2O + 2 H2O
Co(OH)2 + 2 HNO3 = Co(NO3)2 + 2 H2O
Co(NO3)2 + 7 NaNO2 + 4 (H3CCOOH) = Na3[CoNO2)6] + 3 NO2 + 4 (H3CCOONa) + 2 H2O
3. SOLUBILIDADE COMPARATIVA NOS SAIS DE METAIS ALCALINOS:
Geralmente, os sais de rubídio e césio são menos solúveis em água do que sais de sódio ou potássio ,link 3, 4,
Sais de lítio podem eventualmente serem muito solúveis, pois sais de lítio muito ionizados e muito solvatados, são os mais solúveis (átomo pequeno e muita solvatação). MAHLER, J.; PERSSOM, I. Inorg. Chem. 51, 325 (2012). BARD, A.J. “Standard Potencials in Aqueous Solutions.” Editora Routledge, New York, EUA (1985). SKOLUNOV, A.V. Fibre Chem. 25 , 463 (1993)
Mais isso nem sempre ocorre. Exemplo o carbonato de lítio, Li2CO3, é menos solúvel do que o de sódio ou potássio, e o cloreto também, Isso se deve ao raio iônico do ânion carbonato, e também à rigidez do retículo, causada pela maior atração lítio-ânion, devido ao pequeno tamanho do lítio e a proximidade do contra-ânion. Links 5. 6. 7.
4. PRECIPITANTES PARA RUBÍDIO E CÉSIO:
Percloratos, tetrafenilboratos ou picratos de rubídio e césio, podem eventualmente precipitar, como o potássio, dependendo da concentração das soluções. MATSUKAWA, M.; MATSUNAGA, T.; YOSHIDA, M.; FUJIWARA, S. ResearchGate (2003). GAO, L. Et Al. Solv. Ext. Ion Exch. 38, 753 (2020).
Usando um reagente precipitante seletivo, composto de soluções de nitrato de bismuto, nitrato de prata e nitrito de sódio, Na2AgBi(NO2)6, (hexanitrobismutato duplo de prata e sódio) precipita seletivamente apenas o rubídio e o césio, deixando na solução o potássio e o sódio. ISHBASHI, I.; YAMAMOTO, T.; HARA, T. Bull. Inst. Chem. Res Kyoto Japan, 37, 159 (1959).
Outro reagente precipitante seletivo , iodobismutato de sódio, precipita apenas rubídio e césio,na forma de M3Bi2I9 (M=Rb ou Cs) e até os separa de sódio e potássio. YANG, Z. Et Al. J. Nucl. Radiochem. 26, 95 (2004). Esses iodobismutatos tem uma estrutura semelhante , correlata, à do mineral Perovskita.
5. PRECIPITANTES PARA LÍTIO:
Ao contrário do poderia imaginar o Químico iniciante, Precipitar o lítio é relativamente fácil, porque a solubilidade difere bem dos mais conhecidos e comuns cátions de sódio e potássio.
Todos conhecem os sabões comuns, de sódio e potássio, berm como o sabão de coco. Sabem que são solúveis….
A muitos anos [FEDERMAN NETO, A. (1975)] notei que soluções de sabão de coco (que contém sais de sódio de ácidos graxos) não precipitam sais de potássio e sódio, mas sim sais de metais de transição e alcalinoterrosos (bário, cálcio, magnésio), formando muitos sais insolúveis.
Ocorre que notei, também precipitam o lítio! Confirmei isso, FEDERMAN NETO, A. (1980) anos depois. Adicionando solução hidroalcóolica de sabão de coco, a uma solução de cloreto de lítio, o sabão do lítio precipita, pouco solúvel, como um pó branco, e se diferencia do sódio e do potássio.
Tão pouco solúveis são, que os sabões de lítio são usados em graxas e lubrificantes. link 2. As minhas observações sobre o sabões de lítio, nos anos 70-80, foram muito depois confirmadas pela precipitação do sabão de lítio do ácido palmítico, com o palmitato de sódio como reagente. CASTRO DE SALES, A.L.; RAMOS, L.A.;NUNES, L.S.; CLARO NETO, S.; CAVALHEIRO, E.T.G. Quím Nova 31, 1722 (2008).
Especulo que isso ocorra porque o lítio é muito pequeno, quando comparado à cadeia longa lipofílica do sabão, induzindo uma “resistência à água“.
Portanto, você pode usar oleato, palmitato, estearato de sódio como precipitante para o lítio. Ou mesmo o sabão de coco comum, dissolvido em água ou água-álcool.
O fosfato de sódio também pode precipitar sais de lítio.
Mais uma possibilidade para precipitar o lítio. Sais solúveis de lítio, como o cloreto, LiCl , precipitam o lítio com soluções de carbonato de sódio.
Embora solúvel em água, o carbonato de lítio é bem menos solúvel que o carbonato de sódio, e vai precipitar. Links: 19, 20, 21, 22, 23, 24, 25 , 26,
A precipitação do carbonato de lítio ocorre melhor a quente do que a frio, pois (ao contrário da maioria dos sais) carbonato de lítio é menos solúvel a quente do que a frio. Por outro lado, o carbonato de sódio é muito mais solúvel a quente, seguindo o padrão da maioria dos sais.
Assim como o carbonato de lítio, o hidróxido também pode ser precipitando das soluções de sais de lítio, com hidróxido de sódio. Pois hidróxido de lítio tem solubilidade de cerca de 13 a 18 g. por 100 ml (entre 0 e 100 ºC), bem mais baixa que a solubilidade dos hidróxidos de potássio ou sódio.
Mas hidróxido de lítio precipita como monohidrato, LiOH.H2O. E não anidro, como o NaOH e o KOH.
Precipitando o lítio, como carbonato ou hidróxido, você pode isolar e usar os compostos resultantes, como materiais de partida para fazer outros sais de lítio.
2 LiCl + Na2CO3 = Li2CO3 + 2 NaCl
LiCl + NaOH + H2Os = LiOH.H2O + NaCl
Li2CO3 + H2SO4 = Li2SO4 + H2O + CO2
LiOH.H2O + HNO3 = LiNO3 + 2 H2O
6. PRECIPITANTES PARA SAIS DE AMÔNIO:
Alguns precipitantes para potássio (Item 2 e Sub-Itens) também precipitam o sais de amônio. Exemplos: o Cobaltinitrito (2d); o picrato; o tetrafenilborato.
Mas bem clássico para precipitar sais de amônio, é o Reagente de Nessler (tetraiodomercurato de potássio K2HgI4, em solução alcalina). Em outro artigo neste Blog, já tratamos do Reagente de Nessler e sua história (veja no Artigo, Item 4).
O ácido pícrico , o ácido perclórico , o perclorato também podem precipitar os cátions de amônio (como o fariam com o potássio), mas convém evitar, porque os sais de amônio do ânions de alta energia são explosivos perigosos.
Para mostrar a precipitação de amônio, sem perigo de explosão, podemos usar um antigo reagente para fosfato chamado “Mistura Magnesiana“, preparação do reagente, descrita no link, e na Revista O Biológico, pág. 79 (1966). Também em “Vedantu” (2023) e “Chemicals Learning” (2023).
A mistura magnesiana é uma solução de cloreto de magnésio e cloreto de amônio, alcalinizada com amoníaco.
Adicionando à ela, um pouco de um fosfato. LIU, W. Et Al. Chem. Tech. Biotech.88, 181 (2012). Link 6. 7. Veja também: ANDRADE e LANDIM, Loc. Cit. O reagente pode ser adaptado para a análise de magnésio.
A reação é muito antiga, BOLOGNINI, H.; DUCLOUX, E.H (Orientador); “Los Métodos de Análisis de las Aguas Minerales.”Tese de Doutorado em Química, Universidad Nacional de Buenos Aires. Faculdad de Ciencias Exactas de Físicas y Naturales. Editora Imprenta Alsina, Cidade de Victoria, Argentina (1912). TRIMBLE, H. “Practical and Analytical Chemistry.” Editora P. Blakiston, Son & Company, Philadelphia, EUA, 2a Ed.. Pág 34 (1886).
A reação, conhecida desde a Alquimia, na preparação de um antigo Medicamento, “Magnesia Alba”, cuja estequiometria, carbonato de magnésio, MgCO3, foi descoberta pelo químico Escocês Joseph Black. BLACK, J.; CULLEN, W. (Adendo); CREECH, W. (Editor); “Experiments Upon Magnesia Alba, Quick-Lime and Other Alcaline Substances.” Edimburgo, Escócia (1796).
Mas ao que parece, a obtenção do fosfato-amoníaco-magnesiano, foi otimizada em 1899. GOOCH, F.A.; AUSTIN, M. Am. J. Scienc.7, 187 (1899).
Reação bonita e fácil, (eu fiz várias vezes) mas que hoje está relativamente esquecida.
Quando um fosfato solúvel reage com a mistura magnesiana, ocorre a precipitação muito característica do “Fosfato Amoníaco-Magnesiano“, que os Alquimistas chamavam “Sal Microcósmico“. Fosfato duplo de Amônio e Magnésio, NH4MgPO4.6H2O. NEWTH, S. “Manual of Chemical Analysis, Qualitative and Quantitative.” Editora Longmans, Green & Co., Londres Inglaterra, 2a Ed (1899).
MgCl2 + NH4Cl + Na2HPO4 + 6 H2O = NH4MgPO4.6H2O + 2 NaCl + HCl
Os cristais correspondem à estrutura do mineral “Estruvita“. BOROJOVITCH, E.J.C. Et Al. Wat. Environ. Res. 82, 586 (2010). Veja Link 26.
Também era chamado de “Sal Microcósmico” o Fosfato Ácido de Sódio e Amônio, Na(NH4)HPO4. Composto relacionado é o Fosfato Ácido de Magnésio, HMgPO4 , que também pode precipitar. GUARDA, A. “Química Analítica Qualitativa.” Editora Uniasselvi, Indaial, S.C,. Pág. 174 (2019).
7. PRECIPITANTES PARA SÓDIO:
Ao contrário dos outros cátions de metais alcalinos, a maior parte dos sais de sódio são solúveis e, por isso, eles são difíceis de precipitar. Apenas alguns poucos precipitantes para sódio são conhecidos.
Passarei ao largo, sem detalhar isso (embora sejam reagentes muito eficientes), sobre os precipitantes para sódio contendo urânio, link 28, na forma de uranatos , diuranato de sódio, Na2U2O7, e o acetato triplo de sódio, zinco e uranilo, Link 27. NaZn(UO2)3CH3CO2)9·6H2O
O principal motivo para isso? Não esqueçam que urânio, mesmo o natural é radioativo. Embora seja principalmente emissor de partículas alfa, o urânio natural contém pequena proporção de urânio 235, que é gama emissor.
Portanto urânio natural tem um pouquinho de raios gama. Não esquecer que O Físico e Químico Francês Antoine Henri Becquerel observou a Radioatividade no urânio natural! , BECQUEREL, H. Compt. Rend. Hebdo. Seanc. Acad. Scienc. 122, 420 (1896).
A controvérsia sobre a descoberta da Radioatividade e sua correlação com a fluorescência e a fosforescência, pode ser vista neste Artigo.
Por outro lado, o tempo de meia vida, de decaimento alfa do urânio, é muito grande.
Além do pequeno risco da radiação gama, mesmo que pouca, se você se contaminar ao manipular sais de urânio, engolir, ou o sal de uranilo ficar debaixo das unhas…. você vai ficar radioativo pelo resto da vida, e o bombardeamento da partículas alfa é lesivo às células...
Manipular sais de urânio, mesmo natural, sim, é perigoso… Precisa usar luvas, máscara, lavar muito as mãos… Eu , como muitos outros Químicos, não recomendo que materiais radioativos de qualquer espécie sejam manipulados em laboratórios pequenos e amadores.
Esse é o motivo principal para eu não detalhar o uso dos precipitantes para sódio contendo urânio, embora eles sejam eficientes.
Alguns poucos reagentes podem precipitar sódio.
7a. Bismutato de Potássio:
Embora seja um metal relativamente raro, o Bismuto é conhecido desde a Antiquidade, desde os tempos da Alquimia. POLYKARP, J.C. ; VON BAFFENBERG, G.H ((Comentarista); VON TRATTNER, J.T.E. (Editor) “Anfangsgrunde der Chemie.” , Tradução Livre do Título, algo como: “Os Motivos Primordiais da Química.” Várias Páginas, Cidade de Erxleben, Alemanha (1785).
Os bismutatos já eram conhecidos na época de Lavoisier. Veja: SPALDING, L.; DAVIES, M. (Editor), Monografia, “A New Nomenclature on Chemistry.”, Hanover, Alemanha, Pág. 3 (1799).
O grande Químico Francês Edmond Frémy, os estudou FRÉMY, E. “Recherches Sur Les Acides Métalliques.” Editora Bachelier, Paris, França, Págs.: 61, 62 (1844). Mas se tornaria mais conhecido por ter descoberto os complexos de fluoreto, e um radical inorgânico estável, o “Sal de Frémy“. FRÉMY, E. Ann. Chem. Phys. 15, 408 (1845).
A bastante tempo se sabe, complexos de nitrito de bismuto e potássio, podem precipitar sódio. BALL, W.C. J. Chem. Soc. Trans. 95, 2126 (1909). BALL, W.C. J. Chem. Soc. Trans. 97, 1408 (1910).
O bismutato de potássio, KBiO3, pode precipitar sódio, visto que o bismutato de sódio é pouco solúvel em água fria. Menos solúvel que o bismutato de potássio.
Desejando obter direto o sal de sódio, você pode partir de bismuto metal, ou do óxido dissolvido em ácido nítrico e oxidar o bismuto com bromo ou com persulfato de sódio. Link 27., 29.
7b. Piroantimoniato de Potássio:
Mas o melhor reagente para precipitar sódio é o piroantimoniato de potássio. É geralmente, o que uso.
O antimônio, alguns de seus sais, seus óxidos e os antimoniatos, são conhecidos desde a época da Alquimia. Links: 41, 42, 43, 44, “A Carruagem Triunfal do Antimônio.”
O Alquimista alemão Basile Valentin, pseudônimo de Johann Thoide , conhecia o piroantimoniato e os compostos relacionados (embora nada se soubesse sobre sua estrutura) LEICESTER, H.M.; KLICKSTEIN, H.S. “A Sourcebook of Chemistry, 1400-1900″ Harvard University Press, Cambridge, Massachusetts, EUA, Vol. 1, Págs. 27-29 (1952).
O “Antimoniato” de potássio foi introduzido como reagente precipitante para sódio, no século XIX, 1841-1844. WACHENRODER, M. Am. J. Pharm. 10, 37 (1844). FAVROT, C. “Traité Élémentaire…..” Editora Bechet et Labé, Paris, França, Vol. 2, Págs: 59, 97, 98 (1841)
Mas não se conhecia bem sua estequiometria, seja em solução como em estado sólido. GOGUEL, H. “Contribution a L’Étude de Arseniates e des Antimoniates Cristallisés Préparés par Voie Humide.” Livro e Tese de Doutorado (1894).
Mas as possíveis estruturas e as reações dos antimoniatos atraíram a atenção dos Químicos do século XIX. FOWLER, G.H.; GRANT, J. J. Chem. Soc. Trans. 57, 272 (1890) . MEYER, C. Lond. Edin. Dub. Phil. Mag. Series 3, 26, 222 (1848). FRANCIS, W. , CROFT, H. Lond. Edin. Dub. Phil. Mag. Series 3, 19 , 278 (1841).
Atualmente, se conhecem no estado sólido (representado para potássio), os ortoantimoniatos, KSbO3, metantimoniatos, K3SbO4 e os piroantimoniatos, K4Sb2O7 e os antimoniatos ácidos, K2H2Sb2O7 . WOOTEN, J.B.; LONG, G.G.; BOWEN, L.H. J. Inorg. Nuclear Chem. 36, 2177 (1974).
Após o famoso Químico Americano Linus Carl Pauling, os antimoniatos, mesmo sólidos, seriam melhor representados pela fórmula (exemplificada para potássio), KSb(OH)6 . Isso foi confirmado por outros Autores. PAULING, L. J. Am. Chem. Soc. 55, 1895 (1933). JAIN, D.V.S.; BANERJEE, A.K. J. Inorg. Nuclear Chem.19, 177 (1961). BEINTEMA, J. Rec. Trav. Chim. Pays-Bays 56, 931 (1937) .
Mas existem antimoniatos sólidos que não estão na forma de complexos hexahidroxi. Por exemplo, metantimoniato de zinco, Zn(SbO3)2.
Nos dias atuais, se sabe que em solução aquosa alcalina (usada para precipitar sódio), o piroantimoniatos, o óxido de antimônio etc… estão todos hidrolisados, formando o ânion complexo hexa(hidroxi)antimoniato, KSb(OH)6. SKEAFF, J.M. Et Al. Int. Env. Assess. Manag.9, 98 (2012).
Apesar de existirem métodos modernos e otimizados, TANG, Z.; TANG, X.; XIAO, Z.; LIU, H. , Miner. Eng. , 192, 108008 (2023), preparar piroantimoniato de potássio não é muito fácil, em laboratórios pequenos.
Deve-se partir do óxido de antimônio , dissolver o óxido e oxidar com água oxigenada, ou bromo, ou óxido de cobre, ou a partir do tártaro emético e não raro, usar métodos de pirólise, fusão seca.
Quando eu comecei a estudar química, nos anos 70, piroantimoniato não era comercial no Brasil, e meu professor o preparava (para as aulas) . Professor Cândido.
Mas agora, piroantimoniato de potássio pode ser comprado no mercado nacional, embora não seja extremamente barato. Links: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36. 37.
Mas supondo que você não queira mesmo comprar piroantimoniato! Você pode gerá-lo em solução, e guardar, através da preparação do “Reagente de Bougault”, descoberto pelo Farmacêutico e Químico Francês Joseph Félix Ernest Bougault . Link 45, Outro link. CORDIER, P. Ann. Pharm. France 14, 133 (1956).
Ele desenvolveu o reagente para precipitar arsênico, mas notou que também precipitava sódio. Tal como citado por: KAHANE, E. Et Al. Zeit. An. Chem. 99, 130 (1934).
Para preparar o reagente, parta de cloreto de antimônio (III), SbCl3, comprado. Dilua em carbonato de potássio aquoso e concentrado, para formar antimonito, e o antimônio é oxidado à valência (V), com água oxigenada e oxigênio do ar, resultando em uma solução de antimoniato de potássio.
Consegui fazer aqui, o balanceamento dessa complexa reação antiga mas pouco estudada, pois é conhecido (desde 2005) que antimônio (III) só se oxida completamente a antimônio (V), por água oxigenada, quando em presença do oxigênio do ar, e em meio alcalino. LEUZ, A.K.; JOHNSON, C.A. Geochim. Cosmochim. Acta, 69, 1165 (2005).
Minha equação balanceada para preparar o “Reagente de Bougault” , ficou então:
SbCl3 + 6 KOH = K3SbO3 + 3 KCl + 3 H2O OU EM DUAS ETAPAS:
SbCl3 + 3 KOH = Sb(OH)3 + 3 KCl E:
Sb(OH)3 + 3 KOH = K3SbO3 + 3 H2O E A OXIDAÇÃO:
K3SbO3 + 2 H2O2 + O2 = KSb(OH)6 + H2O + 2 KOH
Protocolo experimental moderno para fazer o “Reagente de Bougault” descrito em detalhes: MORITA, T.; ASSUMPÇÃO, R.M.V,; “Manual de Soluções, Reagentes e Solventes.” Editora Blucher, São Paulo, S.P., 2a Ed., Págs. 317 e 645 (2007). Tenho em forma impressa, as duas edições desse importante livro.
A solução de Bougault, ou a de “piroantimoniato” de potássio, links: 36, 37, 38, 39, 40, reage com sais de sódio, precipitando-os.
KSb(OH)6 + NaCl = NaSb(OH)6 + KCl
Preparação do Reagente de Piroantimoniato de potássio, a partir do sal comercial, Referências: Revisão da Farmacopéia Européia e da Farmacopéia Americana USP:
Potassium pyroantimonate solution
Dissolve 2 g of potassium pyroantimonate in 95 mL of hot water. Cool quickly and add a solution containing 2.5 g of potassium hydroxide in 50 mL of water and 1 mL of dilute sodium hydroxide solution. Allow to stand for 24 h, filter and dilute to 150 mL with water.
Variante: Farmacopéia USP:
Potassium Pyroantimonate TS —Dissolve 2 g of potassium pyroantimonate in 85 mL of hot water. Cool quickly, and add 10 mL of a solution of potassium hydroxide (3 in 20). Allow to stand for 24 hours, filter, and dilute with water to 100 mL.
Como vimos até agora, embora partamos de “Piroantimoniato” comercial, ou do “Reagente de Bougault”, o reagente efetivo, na solução, e que precipita o sódio, é o hexa(hidroxi)antimoniato de potássio, KSb(OH)6. JOLOCAN, M. Et Al. Res. J. Chem. Sci. 1, 30 (2011).
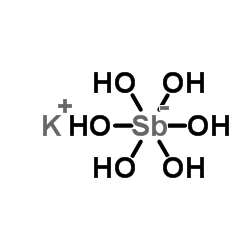
7c. Outros Precipitantes Para o Sódio:
Como vimos, há poucos precipitantes para o sódio. Por isso, nesse caso específico, cito outros reagentes (isentos de urânio) e menos comuns, capazes de precipitar sódio, com suas referências bibliográficas:
Ácido benzaminoantraquinona sulfônico, GOWDA, H.S.; STEPHEN, W.J. An. Chim. Acta, 25, 153 (1961); ácido alfa metoxifenilacético, REEVE, W.; CHRISTOFFEL, I. An Chem., 29, 102 (1957); Diclorobenzoil uréia, SHEIBLY, F.E. J. Org. Chem.,3, 414 (1938); Ácido Dihidroxitartárico, FENTON, H.J.H., J. Chem. Soc. Trans. 67, 48 (1895); FENTON, H.J.H. J. Chem. Soc. Trans. 73, 167 (1898); Ácido Dinitronaftol sulfônico (precipita sódio, mas melhor ainda, o potássio), CLARK, A.W.; WILLITS, C.O. Ind. Eng. Chem. 8 , 209 (1936);

