
.
Autoria: Alberto Federman Neto, AFNTECH.
Revisto, Atualizado e Ampliado em: 19 de Outubro de 2022.
1. INTRODUÇÃO E HISTÓRIA:
Este Artigo trata preferencialmente de um procedimento fácil de obtenção do ácido difenilamino-4-sulfônico e alguns de seus sais e/ou compostos derivados.
São úteis principalmente como indicadores em titulações de oxirredução (titulações redox). Além disso, são interessantes por serem intermediários na preparação de corantes têxteis e medicamentos e também são redutores.
Também se reporta à História da difenilamina e alguns de seus derivados.
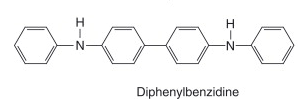
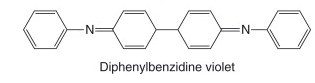
Ela se oxida formando um corante de cor púrpura, violeta, do grupo do bifenilo, Violeta de Difenilbenzidina . Link 33.
O corante pode ser reduzido a sua forma leuco, incolor. Como oxidantes, ferro (III), link 14, dicromatos, permanganatos, vanadatos, link 15, persulfatos ou nitratos.
Em diferentes condições experimentais, a coloração pode ser azul, mesmo verde, e não púrpura. SRIRAMAM, K. Talanta 24, 31 (1977). PANKRATOV. A.N. J. An. Chem. 56, 140 (2001). LU, Y. ; ZHOU, D. Lub. Scienc. 26, 131 (2013). WHITEREAD, T.H.; WILLS, C.C. Chem. Rev. 29, 69 (1941). GREBBER, K.; KARABINOS, J.V. J. Res. Nat Bur. Stand. 49, 2353 (1952).
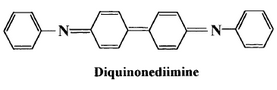
As estruturas propostas para os produtos de oxidação da difenilamina. Veja as referências, links: 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 34. 35, 36.
A formação dessas colorações tornou importante o uso dos derivados de difenilamina, nas reações analíticas de oxi-redução.
Reações, exemplificadas para a difenilamina base. O ácido sulfonado e seus derivados (usados por serem mais solúveis), reagem de maneira similar.

História da Difenilamina e Compostos Relacionados:
A difenilamina base livre, ou sua solução sulfúrica (sulfato de difenilamina, hidrogeno sulfato de difenilamina), pode ser usada como indicador redox, mas prefere-se o ácido sulfônico ou seus sais, por serem mais solúveis.
Ao nível do meu conhecimento, a Difenilamina foi descoberta, observada pela primeira vez, como sub-produto, em 1850, pelo Químico Alemão August Wilhelm Von Hofmann, um dos pioneiros da Síntese Orgânica e da Química dos corantes artificiais. Depois, ele aperfeiçoou os métodos para obtê-la. HOFMANN, A.W.V. Phil. Trans. Roy. Soc. London, 140, 93 (1850). HOFMANN, AWV, Proc. Roy. Soc. London 13, 341 (1864).
Ela pode ser sintetizada em laboratório, GINSBURG, D. (1967). PrepChem. Mas pode ser comprada no mercado nacional e é barata. Links: 1, 2, 3, 4, 10, 11.
A sulfonação direta da difenilamina com ácido sulfúrico já era conhecida antes de 1900, pela sua importância na química de corantes. NIETZKY , R.; (Autor) COLLIN, A; RICHARDSON, W. (Tradutores). “Chemisty of the Organic Dyestuffs. Editora Gurney & Jackson, Londres, Inglaterra (1892).
A sulfonação direta da difenilamina com ácido sulfúrico concentrado e quente, pode ser conseguida com rendimento moderado a alto. GNEHM, R. WERDENBURG, H. Angew. Chem. 12, 1051 (1899), citado em DEASY, C.L.; OESPER, L.E. (Orientador) “The Sulfonation of Secondary Aromatic Amines for Use as Redox Indicators.” Tese de Doutorado em Filosofia. Universidade de Cincinnati, EUA (1940). Links: 4, 5, 6, 7, 8. 9. DIEHL, H. L. Patente Americana, US380098A (1888). MERZ, V.; WEITH, W. Ber. Dtsch. Chem, Gessel. 5, 283 (1872). LISK, G.F. Ind. Eng. Chem. 42, 1746 (1950).
Então, de acordo com os Antigos Químicos Alemães Merz & Weith e Gnehm & Werdenburg, a sulfonação direta pode ser conseguida.
Também um protocolo de sulfonação direta, por irradiação com micro-ondas, existe mas preconiza operar a vácuo. KAPOOR, I.P.S.; KAPOOR, M.; SINGH, G. J. Therm. An. Cal. 102, 723 (2010). Veja também: MARKOVITCH, Y.D. Et al. Russ. J. Gen. Chem. 82, 149 (2012).
Apesar disso, sulfonar esse substrato pode não ser tão fácil, porque a amina livre é reativa, mas o ácido sulfúrico protona o nitrogênio, diminuindo a disponibilidade do par eletrônico. Assim. difenilamina é reativa, mas o sulfato dela, protonado, não o é! CAGLIERI, S.C.; MACANO, L.R. Inf. Tecnol. 27, 105 (2016). Protonação de Difenilamina. DOLMAN, D.; STEWART, R. Can. J. Chem. 45, 154 (1967).

R = Representa o grupo da Difenilamina
RNH2 é Reativa, mas RNH3+-HSO4 , não é. Sulfonação difícil.
RNH2 + H2SO4 = RNH2SO3H (Ácido Difenilamino-4-Sulfônico) + H2O
Outros substratos aromáticos desativados, também são difíceis de serem sulfonados. POPP, F.D. J. Org. Chem. 27, 2658 (1962).
Além disso, produtos coloridos de oxidação ou polímeros, link 1, link 2. Links: 35, 36 , podem se formar, em meio sulfúrico.
Para a sulfonação, Sarver e Kolthoff empregaram ácido sulfúrico fumegante e/ou protegeram e ativaram o grupo amino da difenilamina por acetilação, conversão em acetil difenilamina. SARVER, L.A.; KOLTHOFF, I.M. J. Am. Chem. Soc. 53, 2902 (1931).
Outros pesquisadores empregaram um sulfonante mais ativo, o ácido clorossulfônico. BASSIN, J.B. Et Al. Phosp. Sulf. Silic. Rel. Elemen. 56, 245 (1991). Ibid. 72, 157 (1992). Ibid. 78, 95 (2012).
Outros sulfonantes, como os sulfatos de alquila em meio de ácido sulfúrico foram usados,
Porém são alquilantes e formam N-alquil sulfonatos da difenilamina (seria uma amina terciária derivada da difenilamina sulfonada). COHEN, S.: OESPER, R.E. Ind. Eng. Chem. 5, 364 (1936) . FORREST, J.; TUCKER, D. (Orientador) “Dialkyphenylamines. Their Preparation and Oxidation.” Tese de Cátedra. Dept. of Scientific and Industrial Research. Universidade de Glasgow, Escócia (1941). STRAKA, L.E.; OESPER, R.E. Ind. Eng. Chem. An. Ed. 6, 465 (1934).
(Ph)2NH + (R2)SO4 + H2SO4 = (Ph)(PhSO3H)NR + RSO4OH
A difenilamina é sistematicamente empregada como indicador redox, principalmente desde os anos 20. KNOP, J. J. Am. Chem. Soc. 46, 263 (1924). FURMAN, N,H. Ind. Eng. Chem. 17, 314 (I925) . HAMETT, L.P.; WALDEN Jr.. G.H. J. Am. Chem. Soc. 56, 1092 (1934). KOLTHOFF, I.M.; SARVER, L.A. J. Am. Chem. Soc. 52 4179 (1930),
Mas o uso da simples solução da difenilamina, em ácido sulfúrico como indicador é inclusive, mais antiga. WITHERS, W.A.; RAY, B.J. J. Am. Chem. Soc. 33, 708 (1911). HARVEY, E.M. J. Am. Chem. Soc. 42, 1245 (1920). ESSELEN, Jr., G.J. Ind. Eng. Chem. 12, 801 (1920). LETS, E.A.; REA, F.W. J. Chem. Soc. Trans. 105, 1157 (1914). KNOP. J.; J.Am. Chem. Soc.46, 263 (1924).
Isso levou ao uso corrente do ácido difenilamino-4-sulfônico como indicador; SARVER, L.A.;KOLTHOFF, I.M. J. Am. Chem. Soc. 53, 2909 (1931). KOLTHOFF, I.M.; NOPONEN, G.E. J. Am. Chem. Soc. 55, 1448 (1933).
2. SÍNTESE DO ÁCIDO DIFENILAMINO-4-SULFÔNICO E SEUS SAIS:
Os derivados indicadores, a própria difenilamina e o ácido sulfônico ácido livre e/ou sais de bário ou sódio poderem ser comprados prontos, sólidos ou em solução.
Mas difenilamina é barata mas seus derivados, não. E por isso, e como experimento de Química Orgânica, pode ser interessante prepará-los…
Como vimos na Introdução, a sulfonação da difenilamina, após ser protonada pelo ácido sulfúrico, embora possível, pode não ser tão fácil. Sobre isso, veja: FORT, M.; LLOYD, L.L. “The Chemistry of Dyestuffs.” University Press, Cambridge, Inglaterra (1917).
Certos Autores recomendam usar vácuo. Patente Chinesa, CN1056677A (2014-2016).
A sulfonação da difenilamina pode ser feita direta com ácido sulfúrico , BUHLER,M.F.; LOPEZ, R. CASTRILLON, J.P.A.; MITTA, A.E.A. An. Assoc. Quim. Arg. 48, 214 (1960).
As proporções ideais são quase uma fusão: 1 parte de difenilamina para 1,65 partes de ácido sulfúrico concentrado, a 125-165 ºC. Veja BAZAKIN, V.I.; IVASHCHENKO, A.V. Patente Soviética, SU310903 (1971).
Referências citadas no SciFinder, Chemical Abstracts, um Banco de Dados Químicos de acesso restrito às Universidades, por isso, não consigo lincar: KOLEV, N. Et Al. Patente da Bulgária, Godishnik Nauchnoizsled. Inst. Khim. .Prom. 2, 61 (1963). DZIRWONSKI, K. Et Al. Bull. Int. Acad. Pol. A 506, (1929); BAZAKIN V. I. Et Al.. Patente Soviética, SU310903 (1971). Patente Soviética, SU156557 (1963). PENG, Z. ; QIUJU, Y. Patente Chinesa, CN105017093 (2015).
Ou usando reagentes mais fortes, como ácido sulfúrico fumegante ou ácido clorossulfônico. Contudo, evitei usar tais reagentes, pois não são fáceis de achar, nem de manipular em laboratórios químicos simples.
Por outro lado. é conhecido que a presença de cátions amônio facilitaria a sulfonação de substratos aromáticos desativados, porque a protonação tende a ocorrer na amônia, mais básica. BLAIR, D.,E.; DIEHL, H. An. Chem. 33, 867 (1961).
Reação:
Difenilamina. RNH2. Fenila, Grupo Aceptor de Elétrons. Menos Nucleofílico do que amônia, NH3. CHAURASIYA, D. (2019).
Sulfato de Amônio se formaria como produto inicial, deixando alguma difenilamina livre para ser sulfonada.
3. EXPERIMENTOS PRELIMINARES E TESTES:
A ideia é elaborar um protocolo simples para a síntese do ácido difenilamino-4-sulfônico e alguns de seus sais, sem empregar ácido sulfúrico fumegante nem ácido clorossulfônico, reagentes não comuns em laboratórios pequenos e difíceis de manipular.
Partimos de Difenilamina sólida, comercial no Brasil e barata. Link 38. Marca Êxodo Científica.
Fizemos experimentos estudando variantes de sulfonação da difenilamina, direta ou modificada.
Testes foram feitos em um béquer largo, de 50 ml, que é relativamente grande e muito largo para a quantidade usadas dos reagentes. A razão para isso é para evaporar facilmente a água formada na sulfonação e evitar a reversão (por hidrólise do ácido sulfônico). Por essa necessidade de remover a água, condensadores de refluxo foram evitados.
Aparelhagens, assim, abertas, para remover a água formada na reação, também foram usadas na sulfonação do naftaleno, por ANTYPENKO, O. (2019).
Difenilamina + Ácido Sulfúrico . Sulfonação Direta:
Feita com difenilamina (marca Êxodo Científica), comprada e barata, Links: 12, 13, 14.
0.84 g (5 mMol) de difenilamina e Ácido Sulfúrico concentrado (Ecibra) em grande excesso (4 a 5 ml).
Sem sulfato de amônio (Del Nero). Difenilamina se dissolve formando o sulfato incolor ou amarelado.
Com adição de sulfato de amônio, coloração azul (Azul de Difenilamina, um dos produtos de oxidação), que descolore durante o aquecimento.
Ambas as amostras reagiram por aquecimento a cerca de 170-180 ºC, por 5 horas. O béquer aberto, de 50 ml, facilita a evaporação da água formada.
As misturas reacionais inicialmente são perfeitamente estáveis ao aquecimento, sem formação de produtos coloridos. Porém ficam azuis no final do período de aquecimento da sulfonação.
As reações:
(ph)2NH = difenilamina
(ph)2NH + H2SO4 = (ph)(ph)NHSO3H + H2O (reversível)
(formação do ácido difenilamino-4 sulfônico)
Em presença de sulfato de amônio. No equilíbrio, amônia, NH3, que é protonada preferencialmente , deixando a difenilamina, em teoria, mais livre
(ph)2NH = difenilamina, sulfonável
(ph)2NH2+ = difenilamina protonada, menos sulfonável. NH3 forma (NH4)2SO4, deixando (ph)2NH mais livre para ser sulfonada.
Após o aquecimento, a mistura foi hidrolisada a frio com gelo, mas já observou-se que grande parte da difenilamina não reage e foi recolhida por filtração. Um sólido branco ou levemente amarelado. Essa difenilamina está salificada na forma de bissulfato, posto que esse sal é insolúvel em água, veja as propriedades em PubChem .
(Ph)2NH + H2SO4 = (Ph)2NH+-HSO4
A neutralização do filtrado com hidróxido de sódio aquoso e evaporação, mostrou pouca eficiência dessas sulfonações. Forma-se ainda um pouco de difenilbenzidina, um produto de oxidação, análogo ao descrito por Sarver e Kolthoff. SARVER, L.A.; KOLTHOFF, I.M. J. Am. Chem. Soc. 53, 2902 (1931) .
Em outro experimento, a sulfonação direta foi repetida, sem adição de sal de amônio, e seguindo modificação do protocolo clássico de MERZ, V.; WEITH, W. Loc. Cit.
1,6 g. (10 mM) de difenilamina foi dissolvida em excesso (6-10 ml) de ácido sulfúrico e aquecida, em um béquer ou erlenmeyer largo, de 100 ml, frouxamente tampado com um vidro de relógio. como vimos, um artifício para remover o vapor de água.
Trabalhamos em temperatura bem elevada para contornar a baixa reatividade da espécie protonada e também porque ácido sulfúrico se decompõe em alta temperatura, MEYERS, R.T. J. Chem. Educ. 60, 1017 (1983), e forma só um pouco de anidrido sulfúrico, SO3, ABEL, E. J. Phys. Chem. 50, 260 (1946), o que em teoria, ajudaria a sulfonação:
H2SO4 = SO3 + H2O
A temperatura foi mantida alta (cerca de 160-200 C°). A água formada na reação evapora. Em contraste com a reação em presença de sulfato de amônio, não parece haver nenhuma formação de produto de oxidação azulado.
Após cerca de 4 horas de aquecimento, a mistura vai escurecendo e ficando acinzentada, de acordo com o observado na literatura, isso é indício de que a sulfonação está ocorrendo.
O aquecimento, no dia seguinte , foi prolongado por cerca de mais 2 horas. A mistura vai se tornando semi sólida e de cor cinza escuro. Esfriada em banho de gelo e hidrolisada por adição de gelo.
Um pouco de material resinoso (polímero da difenilamina?) se forma e foi filtrado. O líquido foi neutralizado com bicarbonato de sódio até cessar a efervescência de gás carbõnico e resfriado.
A reação foi repetida, a neutralização com bicarbonato de sódio, carbonato de sódio ou hidróxido de bário, sempre conduziu a baixos rendimentos do derivado sulfonado.
Sulfonação de Difenilamina Acetilada In Situ:
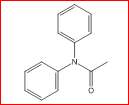
Em uma segunda série de reações, optou-se pela N-acetilação prévia da difenilamina formando o derivado N-acetil, aonde o nitrogênio está bloqueado, para não formar sal.
De fato, é similar ao empregado por SARVER & KOLTHOFF, Loc. Cit., mas, In Situ, sem isolar o acetil derivado intermediário.
Usando Acetilação Para Proteger o Grupo Amino:
É conhecido que a difenilamina sofre acetilação no grupo amino, seja com cloreto de acetila [BAJAJ, A.K.; KUMAR, A. Eur. J. Med. Chem. 19, 369 (2004)] como com anidrido acético [SHIZUKA, H. Et Al Bull. Chem. Soc. Japan 43, 67 (1970)] [MATINYAN, E.E. Proc. Yerevan Stat. Univ. 1, 7 (2013)]
Então, usamos como base um procedimento geral de acetilação de aminas, em excesso de anidrido acético, ou ácido acético, como solvente e catalisada por ácido sulfúrico. BHAT, S.V Et Al. Org. Prep. Proc. Int. 43, 590 (2021). SATCHELL, D.P.N. J. Chem. Soc. 1894 (1962).
É procedimento clássico e conhecido muito tempo. SUDBOROUGH, J.J. J. Chem. Soc. Trans. 79, 533 (1901). BURTON, H.; PRAIL, P.F.G. J. Chem. Soc. 755 (1952).
Chamada Acetilação de Thiele”, Devido ao Químico Alemão Friedrich Karl Johannes Thiele , que a descobriu. THIELE, J.; WINTER, E. Just. Liebig Ann. Chem. 311, 341 (1900).
Embora de início, a Acetilação de Thiele fosse específica para quinonas: BLATCHLY, J.M.; GREEN, R.J.S.MacORNEY, J.F.W.; SEARLE, J.B. J. Chem. Soc. C 1353 (1969).
Já se sabe a muito tempo, que funciona para aminas e para fenóis, em geral. FIESER, F.L. J. Am. Chem. Soc. 51, 1896 (1929). SMITH, A.E.; ORTHON, K.J.P. J. Chem. Soc. Trans. 93, 1242 (1908). SMITH, A.E.; ORTON, K.J.P. J. Chem. Soc. Trans. 95 , 1060 (1908). RAIFORD, R.C.; COLBERT, J.C. J. Am. Chem. Soc. 47, 1454 (1925). BURTON, H.; PRAIALL, P.F.G. J. Chem. Soc. 755 (1952). GILMAN, H.; PARKER, P.T.; BAILIE, J.C.; BROWN, G.E. J. Am. Chem. Soc. 61, 2836 (1939). MELOY, C.R.; HUSTON, R.C. (Orientador), Tese de Doutorado, Ph.D, em Filosofia, Departamento de Química, Michigan State College, Ann Harbon, Michigan, EUA (1942). SCHENCK, G.H.; FRITZ, J.S. An. Chem. 32, 987 (1960) . FATIADY, A.J. Carboyd. Res. 6, 237 (1968).
Vimos, então, que na “Acetilação ou Acilação de Thiele” clássica, amina ou o fenol, ou a quinona, é dissolvida em anidrido acético, ou em mistura de anidrido acético e ácido acético, e um catalisador, ácido sulfúrico ou fosfórico é adicionado. Algumas vezes, outros catalisadores podem ser usados. Ácido perclórico ou um ácido de Lewis, como o cloreto de zinco. Veja BURTON & PRAIALL, Loc. Cit. Há variantes em meio alcalino. CHATTAWAY, F.D. J. Chem. Soc. 2495 (1931) .
Catalisador moderno, sulfato de vanadilo, VOSO4: VALENTINI, F. Et Al. Front. Chem, 10, 842190 (2022) . Atualmente, se sabe, pode ser feito até sem catalisador. ANBU, N. Et Al., Chemistry, 69 (2019).
Protocolo Geral para Fazer Acetilação Tipo Thiele, Para Aminas e Fenóis.
Acilação é uma das mais importantes reações em Síntese Orgânica, links 39, 40. todos os Químicos a conhecem. Eu fiz muito! Dezenas de vezes! É a reação de Síntese Orgânica que mais fiz! E é bem simples.
Se precisar acetilar um Fenol um Amina, dissolva o composto em anidrido acético, ou em uma mistura de anidrido acético e ácido acético. Coloque algumas gotas de ácido sulfúrico ou fosfórico concentrados, como catalisador.
Geralmente o derivado N-Acetil ou o Acetato do Fenol, vai precipitar ou separar, e após a reação, e pode ser isolado adicionando a mistura sobre gêlo.
Para nosso caso, que é a Difenilamina, esta reação ocorrerá no meio, antes que a sulfonação ocorra :
(ph)2NH = difenilamina e (CH3C=O)2O = Anidrido acético
(ph)2NH + (CH3C=O)2O = (ph)2N-(C=O)CH3
Também é conhecido que a reação de sulfonação , que estamos pesquisando, não é prejudicada por anidrido acético ou ácido acético. LISK, Loc. Cit. Veja também, Sulfonação de Naftaleno: CERFONTAIN, H.; TELDER, A. Rec. Trav. Chim. Pays Bas 86, 527 (2010). Inclusive, anidrido acético reage com o ácido sulfúrico, formando um reagente sulfonante. YING, W.B. Et Al. J. Ind. Eng. Chem. 37, 28 (2017).
Assim podemos tentar sulfonar, não a difenilamina livre, mas sim a N-acetil-difenilamina, gerada In Situ, por um protocolo de Acilação de Thiele.
1,69 g. de difenilamina (marca Exodo), 10 mmoles, foram colocadas em um grande frasco erlenmeyer de 500 ml (isso para garantir evaporação da água, como vimos no texto).
Adicionou-se grande excesso de anidrido acético (4-5 ml) e gotas de ácido sulfúrico. Forma-se uma solução de N-acetil-difenilamina, por acilação. Adicionou- se excesso (5-6 ml) de ácido sulfúrico concentrado.
A mistura foi aquecida, com agitação no frasco aberto, por 12 horas, a 170-160 Cº. Forma-se uma solução amarela, fluorescente em verde. Esse corante fluorescente é, possivelmente, uma impureza formada por acilação ácido catalisada, do anel aromático. Veja PLANT, S.G.P.; WORTHING, G.R. J. Chem. Soc. 1278 (1955).
Após o aquecimento, a mistura foi hidrolisada sobre gelo. Forma-se uma coloração azulada, e separa-se um pouco de sólido branco (repetindo-se o experimento, separa-se com cor, as vezes, beige ou verde). N-Acetil-Difenilamina bruta?,
Após derreter o gelo, forma-se uma solução verde clara e um pouco de resina. A resina é polímero de difenilamina, [ORLOV, A.V. Et Al. Polym. Scienc. B, 48, 5 (2006)], e foi separada por decantação.
A mistura foi fervida por 2 horas, para hidrolisar qualquer difenilamina acetilada que ainda houvesse.
Resfriada até Temperatura ambiente e cuidadosamente neutralizada com bicarbonato de sódio (descobri ser melhor do que o carbonato ou hidróxido), até cessar a efervescencia, quando então, o pH medido (com papel indicador) foi entre 6 e 7, praticamente neutro.
Evitei o carbonato de sódio e o hidróxido de sódio, pela neutralização ser bastante exotérmica, o que poderia hidrolisar o ácido sulfônico.
Também evitei o hidróxido, carbonato ou cloreto de bário (tradicionalmente usados em sulfonações, para remover o excesso de ácido sulfúrico) pois grande quantidade de sulfato de bário seria formada, o que iria reter na massa sólida, o composto orgânico desejado.
Novamente a solução foi filtrada, resultando em um ´liquido límpido e ligeiramente amarelado, contendo o difenilamino sulfonato de sódio, misturado ao sulfato de sódio resultante da neutralização. Isolamento do difenilamino sulfonato de sódio, veja abaixo (***)
Solubilidade do difenilamino sulfonato de sódio em água: 820 g/lt (Outro Link) Do sulfato de sódio: a 100 ºC, essa solubilidade é de 281 g/lt.
Por outro lado, sulfato de sódio é totalmente insolúvel em álcool. TORO, I.C.O.; DOBROSG-GÓMEZ, I.; GARCIA, M.A.G. Fluid Phase Equilibria 384, 106 (2014). Mas o difenilamino sulfonato de sódio é muito pouco solúvel.
As solubilidades em solventes orgânicos, quando não conhecidas, podem ser estimadas por cálculo. Método de Abraham. JIAMWEI, L. J. Sol. Chem. 51, 816 (2022). BRADLEY, J.C. Et Al Chem. Cent. J. 9, 12 (2015). ABRAHAM, M.H. Et Al. Phys. Chem. Chem. Phys. 3, 3732 (2001).
Essas propriedades, diferenças de solubilidade, permitiram separar o derivado desejado, do resíduo de sulfato de sódio, como descrito abaixo.
O líquido, veja acima, (***), foi evaporado em uma cápsula de porcelana, com aquecimento moderado, fervendo suavemente. Interrompendo a evaporação assim que secou. É uma mistura do difenilamino sulfonato de sódio desejado, e grande excesso de sulfato de sódio.
O sólido foi extraído com 4 pequenas porções sucessivas de água, a TA. O material alaranjado foi extraído, deixando a maior parte do sulfato de sódio, menos solúvel, obtido com um cristais brancos, clarinhos.
Isso ocorre porque, como vimos, o difenilamino sulfonato de sódio é cerca de 7 vêzes mais solúvel, e é extraido pela água, deixando a maior parte do sulfato de sódio no resíduo.
Além disso, sempre é obtido na síntese, amarelado, o que o diferencia do sulfato de sódio.
Assim se evita o uso de compostos de bário, tóxicos e caros, e que formariam muito sulfato de bário, difícil de extrair.
A solução alaranjada foi novamente evaporada em pequena cápsula de porcelana, em calor suave e sem ferver. Para isso, usei como placa de aquecimento, um fogão elétrico marca Agratto, de relativo baixo custo, igual a este.

O difenilamino sulfonato de sódio obtido, é ainda impuro e contém grandes quantidades de sulfato de sódio, mas já pode ser usado como indicador.
O fato é que fogões elétricos de placa , como estes, ou de resistência blindada, como estes, são excelentes para uso no laboratório químico. O tipo mais antigo, com placa de porcelana e de resistência aberta, como estes (os usados para acender Narguiles), funciona e tem muito poder calorífico, mas não são duradouros, estragam muito facilmente.
Todos esses fogões pode ser usados no lugar das, muito mais caras, placas de aquecimento em Química. Como equipamentos de laboratório improvisados. Vejas estes meu Artigos: 1 e 2.
Outra Modificação:
A sulfonação do produto acetilado In Situ, (com acetilação tipo Thiele) foi mais uma vez, modificada:
1,7 g. (0,01 mol) de difenilamina foi colocada em um béquer largo ou erlenmeyer largo (125 ou 250 ml), como descrito nos outros experimentos.
Adicionou-se excesso (2 ml, cerca de 0.022 moles) de anidrido acético (marca Merck) e dissolveu-se o sólido. Adicionou-se 4 ml (cerca de 0,075 mol) de ácido sulfúrico concentrado.
Agitando a mistura a TA, verificou-se que a N-acetildifenilamina se separa como cristais brancos.
A mistura foi aquecida a 160 ºC (temperatura aproximada, medida na regulagem do agitador mecânico), por 12 horas. Com aquecimento intermitente, interrompendo e continuando no dia seguinte.
Durante a sulfonação, a água formada e o ácido acético, e o excesso de anidrido, foram evaporando, graças ao frasco grande e largo que foi usado.
4 . OTIMIZAÇÃO:
Sulfonação direta.
Partiu-se sempre de 1,7 g (0.01 mol) de difenilamina, que foi sulfonada por aquecimento, por 12 horas, a cerca de 160 °C, com proporções de ácido sulfúrico concentrado. De 0.0165 (proporção recomendada por BAZAKIN, V.I.; IVASHCHENKO, A.V, Loc. Cit.) até 0.06 ou 0.08 equivalentes.
Resumo, para 1 mol de difenilamina, usar 1,65, ou 6 ou 8 moles de ácido sulfúrico.
Acetilação e Sulfonação.
Partiu-se de 1,7 g (0,01 mol) de difenilamina, que reagiu com 0,02 moles de anidrido acético e 0,06 moles de ácido sulfúrico.
Isolamento de Difenilamino Sulfonato de Sódio.
A mistura da sulfonação (acética ou não) foi diluída com água e fervida por 15 a 20 min. Isso hidrolisa qualquer acetil derivado que posssa existir, caso o anidrido tenha sido utilizado. A mistura foi esfriada e neutralizada com bicarbonato de sódio sólido, até cessar a efervescência.
Resulta numa solução neutra, de pH 7 a 7,5. Evaporando-se essa solução, obtem-se uma mistura sólida de difenilamino sulfonato de sódio e sulfato de sódio.
Extraindo-se com 4 porções sucessivas de água fria, isso extrai o difenilamino sulfonato de sódio (mais solúvel) e deixa sulfato de sódio (menos solúvel, comparativamente).
A evaporação da água a cerca de 60 ° C, deixa o Difenilamino Sulfonato de Sódio, como um sólido beige. Rendimento moderado, de 63 a 68 %, mas não puro. Ainda contém uma quantidade de sulfato de sódio considerável., mas já é possível empregá-lo como indicador redox.
(Ph)2NH + H2SO4 = (Ph)(PhSO3H)NH + H2O
(Ph)(PhSO3H)NH + NaHCO3 = (Ph)(PhSO3Na)NH + H2O + CO2
Grande parte da impureza de coloração beige, pode ser removida por tratamento da solução aquosa quente do difenilamino sulfonato de sódio, com carvão ativado, de maneira clássica.
Difenilamino Sulfonato de Bário:
Uma mistura de sulfonação direta foi obtida, diluída com água como descrito acima, e neutralizada por adição de hidróxido de bário a 30 % ou de carbonato de bário sólido (invés de bicarbonato).
O sulfato de bário formado foi filtrado e o sólido extraído várias vezes com água quente.
A evaporação do extrato aquoso fornece o difenilamino sulfonato de bário, como um sólido beige claro, pouco solúvel em água. ELLEEF, E.M.A,; GOMAA, E.A. Int. J .Eng. Innov. Technol. 3, 308 (2013).
(Ph)2NH + H2SO4 = (Ph)(PhSO3H)NH + H2O
2 (Ph)(PhSO3H)NH + Ba(OH)2 = 2[(Ph)(PhSO3-)NH]Ba++ + H2O
Alternativamente, pode-se preparar o sal de bário, reagindo o sal de sódio com com uma quantidade estequiométrica de cloreto ou de nitrato de bário.
2 (Ph)(PhSO3-+Na)NH + BaCl2 (ou Ba(NO3)2 = 2[(Ph)(PhSO3-)NH]Ba++ + 2 NaCl (ou 2 NaNO3)
Um outro procedimento, isola o sal de bário, ou ácido livre, com economia do bário. Veja abaixo.
Ácido Difenilamino Sulfônico Livre:
1,7 g de difenilamina foram dissolvidas em 3-6 ml de ácido sulfúrico e sulfonadas por aquecimento a 170 ºC, por 4 horas.
(***) – A adição dessa mistura sobre pouco gelo ou água gelada, precipita o ácido difenilamino-4-sulfônico, como cristais deliquescentes e transparentes, que foram isolados filtrando a vácuo, usando um funil de placa porosa. Rendimento 89 %.
O material pode contem impurezas de ácido sulfúrico, produtos de oxidação (que deixam a solução ficar escura) ou ácido dissulfônico, mas pode ser isolado sólido.
Também verifiquei que aquecendo, a 160-170 °C, a difenilamina dissolvida a 1 % em ácido sulfúrico concentrado…. (É a solução de Difenilamina sulfúrica, links: 41, 42, 43, 44 ).
Obtém-se uma solução que contém o ácido difenilamino-4-sulfônico, SEYEWETZ, A.; SISLEY, P. “Chimie des Matières Colorantes Artificielles.” Editora G. Masson, Paris, França, Pág 308 (1896). COHEN, S.; OESPER, R.E. (Orientador), Tese de Doutorado em Filosofia, Universidade de Cincinatti, Ohio, EUA (1936) . KOLTHOFF, I.M.; SANDELL, E.B.; MOSKOVITZ, B. J. Am. Chem. Soc. 55, 1454 (1933).
De acordo com DEASY & OESPER, Loc. Cit. (1940) , também o ácido dissulfônico pode ser formado, nessas condições.
A solução pode ser usada diretamente com indicador.
Ácido Difenilamino Sulfônico . Isolamento como Sal de Bário. Procedimento Econômico.
O procedimento abaixo, isola o difeniilamino-4-sulfonato de bário, com economia, menos gasto dos custosos compostos de bário.
Uma solução sulfúrica concentrada de ácido difenilamino sulfônico, foi obtida como descrito acima, em (***).
(Ph)2NH + H2SO4 = (Ph)(PhSO3H)NH + H2O
Diluída com 30 ml de água e neutralizada com bicarbonato de sódio até cessar a efervescência, ou pH 6,5-7.
(Ph)(PhSO3H)NH + NaHCO3 = (Ph)(PhSO3Na)NH + H2O + CO2
Tratada com carvão ativo (para tirar qualquer material resinoso) e filtrada por papel pregueado.
A solução foi precipitada com uma solução aquosa de cloreto ou de nitrato de bário, até cessar a precipitação de sulfato de bário. Este foi filtrado, extraído e lavado com água.
2 (Ph)(PhSO3Na)NH + BaCl2 ( ou Ba(NO3)2 ) = ( (Ph)(PhSO3)-)2-Ba++)NH + NaCl (ou NANO3) + BaSO4 (do ácido sulfúrico em excesso)
O sal de bário foi isolado por evaporação do filtrado. Difenilamino-4-Sulfonato de Bário.
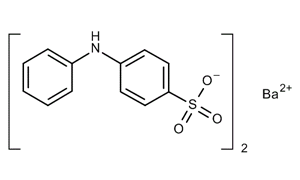
5 . RESULTADOS, DISCUSSÃO, RESUMO E CONCLUSÃO:
Vários experimentos foram feitos, estudando a sulfonação da difenilamina comercial e barata no Brasil, com o o objetivo de obter o ácido difenilamino- 4-sulfônico, e alguns de seus sais derivados.

Meus experimentos mostram que a acetilação prévia da difenilamina, não é rigorosamente obrigatória, mandatória. A base livre também sofre sulfonação, embora não com facilidade.
Foram sintetizados o ácido difenilamino-4-sulfônico e seus sais de sódio e bário.
A sulfonação direta pode ser feita, quase como uma “fusão” da difenilamina, com apenas 2,4 eq. de ácido sulfúrico, até com excesso de 6 a 8 ml para cada 10 mmoles de difenilamina. Aquecimento por 4 a 12 horas, entre 160 e 170 ºC.
Também o aquecimento da difenilamina dissolvida no ácido sulfúrico forma o ácido sulfônico desejado.
O tratamento da mistura reacional, com pouca água fria ou gelo, precipita o ácido difenilamino-4-sulfônico, como agulhas transparentes, impurificada com algum produto de oxidação, escuro. Há evidências de formação de ácido dissulfônico.
Diluindo-se mais a mistura, e neutralizando com bicarbonato de sódio, obtem-se o difenilamino-4-sulfonato de sódio, misturado com sulfato de sódio, e do qual pode ser separado por ser muito mais solúvel em água do que o sulfato de sódio.
O difenilamino-4-sulfonato de bário pode ser preparado pela neutralização da solução sulfúrica aquosa, com hidróxido ou carbonato de bário, e extraído com água (separado do sulfato de bário precipitado).
Bem como por tratamento do difenilamino-4-sulfonato de sódio, com solução aquosa de cloreto ou de nitrato de bário, mas os rendimentos são menores.
Os rendimentos são moderados e os meus resultados corroboram quando comparados com a literatura conhecida.
Os compostos obtidos são úteis como indicadores em titulações de óxi-redução.

