
Autoria: Alberto Federman Neto, AFNTECH.
Revisto e Ampliado em: 5 de Julho de 2023.
Este Artigo é uma revisão, contendo a História do muito conhecido analgésico, antitérmico e anti-inflamatório AAS, ácido acetilsalicílico, também chamado Aspirina, (nome registrado pela Bayer).
Também medicamentos relacionados, como o salicilato de metila, Paracetamol (Acetominofen), Fenacetina e a Dipirona. E algumas reações simples de identificação desses compostos.
1. INTRODUÇÃO. ANTES DOS SALICILATOS SINTÉTICOS:
Desde a antiguidade, o Homem e os médicos procuraram meios de aliviar a dor. Os analgésicos.
Há reportos de que os Sumerianos usavam folhas de Salgueiro Branco, (Salix alba), como analgésico. Também os Chineses, os Egípcios e os Gregos usavam essa planta. GRIPPE, T.C. CREMESP, Conselho Regional de Medicina do Estado de São Paulo, São Paulo, S.P. (2016). GRIPPE, T.C. Revista Ser Médico CREMESP, 74 , 28 (2016). MONTINARI, M.R.; MINELLI, S.; DE CATERINA, R. Vascul. Pharmacol. (2019).
Também foi muito pesquisado e usado na Europa, desde o século XIX. CARVALHO, N.A (Aluno); DIAS, P.A (Orientador), “O Ácido Salycilico e Seus Compostos” Dissertação Inaugural, Escola Médico-Cirúrgica do Porto, Porto, Portugal (1879).
No Brasil, cultivado, parecido com o “Salgueiro” existe o “Chorão”, originário da Ásia, Salix babylonica.Também tem propriedades analgésicas.HAEFFNER, R.; HECK, R.M.; CEOLIN, T.; JARDIM. V.M.R.; BARBIERI, R.L., Rev. Elet. Enf. Ufg 14, 596 (2014).
Em 1824, dois Farmacêuticos Italianos, Bartolomeo Rigatelli e Francesco Fontana isolaram da casca do Salgueiro, uma substância analgésica muito amarga, que Fontana chamou Salicina. MARSON, P.; PASERO, G. Reumatismo, 58 , 66 (2006). FONTANA, F. Giornale di Farmacia-Chimica, 1 , 644 (1824). Wikipedia Itália, “Salicilati.“. RIGATELLI, B. Annali Universali di Medicina, 39 , 230 e 572 (1826).
Por volta de 1830, a extração da Salicina havia sido melhorada por vários Químicos, dentre eles os Franceses: Louis Joseph Gay-Lussac e Théophile Jules Pelouze. PELOUZE, J.; GAY-LUSSAC, L. Ann. Phys.95 , 304 (1830). O Francês Henri Braconnott, BRACONNOT, H. Ann, Phys.96 , 621 (1830). E pelo Farmacêutico e Químico Alemão Johann Andreas Buchner BUCHNER, J.A.; GOLDFUSS, A.; SCHRAG, J.L. (Editores) “Lehrbuch der Analytischen Chemie und Stochiometrie.” Nuremberg, Alemanha (1836).
Buchner isolou a Salicina pura em 1828, mas presumia que se tratasse de um alcalóide. BUCHNER, J.A. Repert. Pharm. (1828). Link 1.
Mas foi o farmacêutico Francês Pierre Joseph Leroux que a isolou muito pura, descobriu que não era um alcalóide e a sistematizou, do ponto de vista Farmacêutico e Médico . LAFOND, O. Rev. Hist. Pharm.354 , 209 (2007). LEROUX, P.J. memória apresentada por GAY-LUSSAC, MAGENDIE, J. Chim. Med. Pharm. Toxicol. 340 (1830).
O Famoso e Grande Químico Italiano Raffaele Piria estudou detalhadamente a Salicina , e por sua hidrólise, obteve o álcool salicílico e por oxidação, o ácido salicílico. Também preparou o mesmo ácido, a partir do aldeído. Várias referências entre (1838 e 1840). Trabalho completo: PIRIA, R. Ann. Chim. Phys. 257 (1845).
Por neutralização do ácido livre, surgiria um dos primeiros salicilatos, salicilato de sódio, usado para dores e febre, TOMKINS, H. Lancet, 117, 455 (1881). e para tratar reumatismo. KENNEDY, G.W. Am. J. Pharm. 592 (1877). POWELL, R.D. Bull. Soc. Anat. 306 (1847). LATHAM, P.W. Brit. Med. J. 1, 46 (1882). SQUIRE, W. Brit. Med. J. 1, 325 (1877).
Revisão histórica completa da descoberta e uso do Salgueiro, Aspirina e Salicilatos: DESBOROUGH, M.J.R.; KEELING, D.M. Brit. J. Haem. 177, 674 (2017). MAHDI, J.G. Et Al. Cell. Prolif. 39, 147 (2006).
A estrutura molecular, fórmula molecular plana, do ácido salicílico começou a ser confirmada por vários Químicos Europeus:
Exemplos: Remsen confirma a estrutura pela fusão alcalina do ácido benzóico orto sulfonado: REMSEM, I. Am. J. Scienc. 29, 354 (1873). Henkel, pela oxidação da Salicina. HENKEL, S.H. Am. J. Dent. Scienc. 10, 105 (1876). Cahours (veja Salicilato de Metila, 3A) o prepara pela hidrólise da essência natural de Gaultheria. CAHOURS, M.A. Ann. Chim. Phys. 29, 87 (1845). Também a estrutura foi confirmada pela preparação, síntese, de seus derivados clorados ou nitrados: MUSPRATT, J.S.; HOFMANN, A.W. Mem. Proc. Chem. Soc. 3, 110 (1845); E um derivado funcional muito estável, a salicilamida. MUSPRATT, J.S.; HOFMANN, A.W. Lond. Edin. Dub. Phil. Mag. Series 3, 26, 1845 (1845). Miller trabalhou na síntese dos ácidos iodosalicílico e dihidroxibenzóico. MILLER, A.K. J. Chem. Soc. Trans. 41, 298 (1882).
Outros Químicos obtém o ácido salicílico a partir da Cumarina. BLEIBTREU, H. Mem. Proc. Chew. Soc. 3, 205 (1845). Chiosa o prepara do ácido benzóico orto clorado: CHIOZA, M.L. Compt. Rend. Hebdo Seanc. Acad. Scienc. 850 (1852); CHIOZA, M.L. Ann. Chim. Phys. 36, 102 (1852).
Sobre detalhes desses trabalhos na elucidação da estrutura do ácido salicílico, veja: WISNIAK, J. Educ Quim. 33, 210 (2022). WISNIAK, J. Educ. Quim. 24, 451 (2013). GOLDBERG, I. (Aluna); ULLMANN, F. (Orientador) “Recherches sur Quelques Dérivés Acides Alcoyle-Oxybenzoiques.” Tese de Doutorado em Ciências, Faculdade de Ciências da Universidade de Genebra, Suiça (1897).
Até este ponto, são medicamentos salicilados naturais, ou semi-sintéticos, isto é, obtidos a partir de um material de partida de origem natural, a casca e as folhas do Salgueiro.
2. SALICILATOS SINTÉTICOS E ASPIRINA:
Havia já algumas sínteses químicas do ácido salicílico, mas elas eram complexas.
Mas o ácido salicílico foi preparado mais facilmente por Síntese Química, Síntese Orgânica, a partir de fenol e gás carbônico, Carboxilação de Kolbe-Schmitt, pelo Químico Alemão Adolph Wilhelm Hermann Kolbe .E modificada da reação original, por Rudolf Schmitt. KOLBE, H. J. Liebig Ann. Chem. 113, 125 (1860). SCHMITT, R. J. Prakt. Chem. 21, 397 (1885).
Através desse trabalho, inequivocamente, Kolbe confirmou a estrutura do ácido salicílico. KOLBE, H.; LAUTMANN, E., J. Liebig Ann. Chem. 119, 136 (1861).
Aspirina, Ácido Acetilsalicílico. Tradicionalmente, na História da Química, a invenção do Ácido Acetilsalicílico, em 1897, é atribuída ao Químico Alemão da Bayer, Felix Hoffmann , para ajudar seu pai, que sofria de Artrite Reumatóide.
O composto e o nome teriam sido patenteados em 1899, pela Bayer, na Alemanha, com o nome de Aspirina. Bayer, Aspirin (2023). DRESER, H. Archiv. Gesam. Physiol . Mensch. 306, (1899).

Mas a patente alemã não é fácil de localizar. Hoffmann a patentearia no EUA e na Inglaterra. Patente Americana, US644077A (1898-1917). Patente Britânica, 1899091213A (1899) Mas há outras patentes, de outras pessoas, por volta da mesma época. NEWTON, H.E. Patente Britânica GB189827088A (1898-1899). LEDERER, L. Patente Americana, US671769A (1900-1901)
Mas um superior de Hoffmann, na Bayer, Ernst Arthur Eichengrün , dizia que Hoffmann havia sido orientado por ele, e que ele já havia preparado antes de Hoffmann, o derivado acetilado do ácido salicílico. EICHENGRUN, A. Angew. Chem. 12, 1147 (1899). EICHENGRUN, A. Angew. Chem. 13, 55 (1900). SNEADER, W. Lancet, 352, 1697 (1998).
Esses produtos de acilação do ácido salicílico foram reportados tardiamente por Eichengrun, em 1949, mas teriam sido preparados pouco antes de 1897. EICHENGRUN, E.A. Pharmazie, 4, 582 (1949).
Mas podem ter sido observados até antes, pela reação do ácido salicílico com ácido acético. ROGERS, W. (Aluno), HUBNER, H. (Orientador) “On Some of the Derivatives of Salicylic Acid.” Tese de Doutorado em Filosofia, Georg-August University Gottingen, Dundee, Escócia (1875).
Mesmo Aspirina pode ter sido feita bem antes, em 1857, pelo Químico Franco-Alemão Charles Frédéric Gerhadt. GERHARDT, C.F. J. Liebig Ann. Chem. 87, 149 (1857). BACHOFFNER, P. Rev. Hist. Farm. 45, 411 (1997).
Em todo o caso, Aspirina, oficialmente, descoberta de Felix Hoffman, Science History Institute (2017). Na indústria farmacêutica Bayer. Ela foi usada como analgésico, antiinflamatório e antipirético, a partir de 1899.
Referências sobre essa controvérsia toda. SNEADER, W. BMJ, 321, 1591 (2000). LICHTERMAN, B.L. BMJ, 329, 1308 (2004). History of Aspirin, Wikipedia. GILL, K.E., Mastodon, Wired Pen, “Bayer Aspirin” (2022). Site ASTRONKO, Rússia, “Quién Inventó la Aspirina?” (2023). SCHROR, K. “Acetylsalicylic Acid.” Editora Wiley-VCH, Weinhein, Alemanha, 2a Ed., (2016). PEARCE, J.M.S. (2014).
3. RELACIONADOS À ASPIRINA:
Existem alguns outros analgésicos, antipiréticos e anti-inflamatórios (naturais ou sintéticos) cuja estrutura química é correlata à da Aspirina. Trataremos deles.
Importante destacar um anti-inflamatório, analgésico e descongestionante de extenso uso externo, tópico. Componente de muitas pomadas e linimentos para contusões, tipo Gelol, Bálsamo Benguê, Salonpas, Vick Vaporub, Dorgex, Calminex etc…
É o salicilato de metila, 3A .
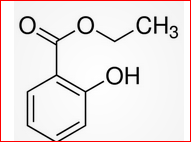
Ele é um dos principais componentes do óleo essencial de “Wintergreen” (Verde Invernal), Gaultheria procumbens“. uma planta originária da América do Norte, EUA e Canadá. Link 2.
A planta e seu óleo, já eram usados em Medicina, antes do século XIX. CULPEPER, N. “The English Physician Enlarged.” Editora S. Ballard, L Hawes and Co., Londres, Inglaterra, Pág. 157 (1765). MARTIN, B. (Autor), OWEN, W. (Editor) “The Natural History of England.”, Londres, Inglaterra, Pág. 34 (1759).
A extração e a composição química do óleo foram estudadas a partir de 1872. VRY, J.E. Am. J. Pharm. 71 (1872). KENNEDY, G.W Am. J. Pharm. 0-1 (1882).
Ficou bem estabelecido que o óleo de Wintergreen contém salicilato de metila. BRANNT, W.T. “A Practical Treatise on Animal and Vegetable Fats and Oils.” Editora Henry Carey Baird & Co. , Philadelphia, EUA, 2a Ed., Vol. 2, Págs.: 246, 256, 259, 261, 270, 276, 277, 292, 298, 420, 532-534, 617,716,727 (1896).
A extração do óleo, e a primeira síntese do salicilato de metila , por esterificação, foram estudadas pelo Químico Francês Auguste André Thomas Cahours. E ele identificou que o produto sintético é idêntico ao óleo natural CAHOURS, A Ann. Chim. Phys. 327 (1844). Os resultados foram confirmados pelo também Francês, Charles Gerhardt, supra citado. GERHARDT, C. J. Chem. Soc. 7 , 60 (1855).
Pela mesma época, Procter mostrou que o éster hidrolisava, isto é que salicilato de metila revertia ao ácido salicílico quando tratado com álcalis. PROCTER Jr., W. Lond. Edin. Dub. Phil. Mag. 25, 480 (1844). PROCTER Jr., W. Am. J. Pharm. 9, 1 (1844).
Os éteres e os ésteres eram na época chamados, respectivamente de “éteres-óxidos” e “éteres-sais”. PAILLOT, R. J. Phys. Theor. App. 6, 615 (1897). Mas o termo éster era usado na Alemanha. WILHELM, W.; GROSSMANN, A. J. Liebig Ann. Chem. 277, 375 (1893).
O primeiro processo prático para fazer o salicilato de metila, em grandes quantidades, para o uso em Farmácia e Perfumaria, usou a reação entre o ácido salicílico e metanol, catalisada por gás clorídrico, ou por ácido sulfúrico. THAYER, H.T. Am. J. Pharm. 243 (1895).
Tanto o salicilato de metila sintético, como o óleo natural extraído, agora são fabricados em larga escala e tem grande importância comercial, e em Farmácia e Química. LUO, B. Et Al. Food Chem. 342, 128244 (2021). Patente Chinesa, CN1092267911A (2011).
Os métodos modernos atuais de se obter o salicilato de metila, são baseados na clássica esterificação direta (otimizada, de FISCHER, E.; SPEIER, A. Ber. Dtsch, Chem. Gessel. 28, 3252 (1898)) do ácido salicílico, com metanol, catalisada por ácido sulfúrico,
A preparação do salicilato de metila é muito conhecida prática de Química Orgânica, veja muitas referências no link 3, e usual em muitos livros texto!. Por exemplo: VOGEL, A.I. (Autor) FURNISS, B.S.; HANNAFORD, A.J.; SMITH, P.W.G.; TATCHELL, A.R. (Revisores), “Vogel’s Textbook of Parctical Organic Chemistry.” Editora Longman Scientific & Technical Group UK Limited, Londres, Inglaterra, 5a Ed., Pág. 1078 (1989).
Ou pode ser preparado mais rapidamente, pela esterificação ou transesterificação da Aspirina. LA GATTA, F. “Cornell Center for Materials Research.” (2007-2015) . HARTEL, A.M., HANNA Jr., J.M. J. Chem. Educ. 86, 475 (2009). SANTOS, S.L.B. Molecules, 27, 4767 (2022).
Outros métodos de obtenção, veja: Maestro Virtuale.
3B. Anilina e Acetanilida ou Antifebrina:
A acetanilida tem apenas interesse histórico como analgésico, pois é muito tóxica. Mas é a matéria prima dos antibacterianos tipo Sulfa.
A estrutura da anilina (estrutura, é o aminobenzeno) foi descoberta a partir das pesquisas sobre a estrutura do Índigo, um corante natural. MacRAE, A.S. Science, 6, 62 (1880). REIMANN, M.; CROOKES, W. (Revisor) “On Aniline and It’s Derivatives.” Editora John Wiley & Son, New York, EUA (1868).
Mas como composto químico, a anilina já havia sido obtida, como artefato de reação, em 1826, UNVERDORBEN, O. Ann. Phys. 84 , 397 (1826). Mas foi isolada e caracterizada depois do alcatrão da hulha, pelo Químico Alemão Friedlieb Ferdinand Runge . RUNGE, F.F. Ann. Phys. 107, 65 (1834). Veja: PLATER, M.J.; RAAB, A. J. Chem. Res. 40, 758 (2016).
A acetanilida é o produto de acetilação da anilina. N-acetil anilina. Foi obtida em 1874, por Hoffman, da Bayer, o mesmo da aspirina, Loc. Cit. FRASER, T.R. Brit. Med. J. 1, 344 (1890). FURSTENWERTH, H. Circulation, 124, 332 (2011). FUSTER, V.; SWEENY, J.M., Circulation, 123, 768 (2011). BLATT, C. J. Am. Chem. Soc. 18, 142 (1896).
Muito estudada, pois é facilmente obtida pela reação entre a anilina e anidrido acético ou ácido acético. e é empregada como matéria prima na síntese química de todas as drogas antibacterianas tipo sulfa.
Ela foi introduzida na prática médica, como antitérmico em 1886, com o nome de “Antifebrina“, principalmente na Alemanha e na França . COLEMAN, M.L; MOON, J.S. (2021). CAHN, A.; HEPP, P. Centralblatt Klin. Med. 1, 561 (1886). CAHN, A.; HEPP, P. Am. J. Pharm. 58, 565 (1886). HAILEY, P.O.W. Indian Med. Gazz. 23, 168 (1888). MUNICIO, A.M. Rev Cienc. Real Acad. Scienc. Espanha, 345, 53 (2023).
Mas como já dissemos, acetanilida se revelou muito tóxica e cheia de efeitos colaterais, e hoje, só tem interesse histórico, como medicamento. COLEMAN, M.L.; MOON, J.S. Anesthesiology, 134, 783 (2021).
3C. Fenacetina:
Citamos a acetanilida, porque ela foi a base de um antigo analgésico salicilato que foi importante. A 4-etoxiacetanilida ou Fenacetina. O primeiro fármaco totalmente sintético.

Há vários reportos (veja links citados em 1 e 2) de que o Químico Americano HN Morse (veja 3D) teria sintetizado a Fenacetina em 1886. Veja por exemplo, links, 3, 4, 5, 6, Mas há um erro nisso. VALLENTE, R. (2015).
Morse sintetizou, foi sim, o paracetamol (veja no Item 3D). OGEMDI, I.K. Int. J. Pham. Chem. 5, 31 ((2019). De fato, ao ler o artigo original de Morse, não achei nenhuma menção à síntese de qualquer outro derivado, além do paracetamol.
A primeira menção à fabricação industrial da Fenacetina, é uma patente Americana, obtida pela companhia farmacêutica de origem Alemã, a Bayer. INSBERG, O. Patente Americana US400086A (1888-1889). Outro Link.
De fato, o Químico Alemão Oscar Heinrich Daniel Hinsberg foi o verdadeiro descobridor da Fenacetina, como fármaco, tal como demostrado em vários links. Ele próprio reporta o fato cerca de 10 anos depois. HINSBERG, O. J. Liebig Ann. Chem. 305, 276 (1899). KONANTZ, W.A. J. Am. Pharm. Assoc. 8, 284 (1919). Link 7.
Mas como composto químico novo, já havia sido obtido, em forma impura (1879), como derivado funcional do 4-aminofenetol. HALLOCK, E. J. Am. Chem. Soc. 1, 485 (1879).
Fenacetina foi Introduzida em Medicina após 1887-1888. ROYDEN, B. Deutsch. Med. Wochen. 14, 366 (1888). CROMBIE, S.M.A. Indian Med. Gaz. 24, 193 (1889). MAHNERT, F. Deutsch. Med. Wochen. 14, 1027 (1888). ARONSEN, H. Am. J. Pharm. 103 (1892). SCHRODER, M.J. Archiv. Pharm. 227, 226 (1889). CARSLAW, J.H. Glasgow Med. J. 30, 64 (1888).
No Brasil, usada também desde o século XIX. ARDUIN, D. O Brasil Médico, An. Acad. Med. Rio de Janeiro, 255 (1888).
Curiosamente, a muito tempo, século XIX, (1895), se sabe, Fenacetina é tóxica e perigosa! CERNA, D. J. Am. Med. Assoc.24, 711 (1895). PAGE, C.E. Hom. Phys. 15, 94 (1895).
Também se suspeita ser cancerígena! YU, M.C.; ROSS, R.K. (2002). REIS, L.O.; FÁVARO, W.J.; CAGNON, V.H.A.; FERREIRA, U. “Modelos experimentais de carcinoma urotelial do trato urinário superior.” Revista Einstein, 7, 525 (2009). FISHBEIN, L. IARC Sci. Pub. 40 , 287 (1981).
Atualmente, está banida em todo o Mundo, entretanto, foi muito usada como analgésico no Brasil e no mundo todo, até as décadas de 60 e 70! ANGERVALL, L. Et Al. Brit. J. Urol. 41, 401 (1969). VÁRIOS AUTORES (1970). E mesmo bem depois disso! CLISSOLD, S.P. Drugs, 32, 46 (1986). PEREIRA, M.A. Et Al. Headache Medicine , 8, 38 (2017). VIEIRA, A.L.; FRANÇA. G.G. Rev. Acad. Oswaldo Cruz, 6, 1 (2015).
3D. Paracetamol ou Acetaminophen:
Paracetamol, também chamado Acetaminophen (nome Americano). SMITH, H.S. Pain Physician, 12, 269 (2009). É um metabólito ativo da Fenacetina. O p-acetilaminofenol.

O Paracetamol foi sintetizado pelo Químico Americano Harmon Northrop Morse , em 1878. MORSE, H.N. Ber. Dtsch. Chem. Gessel., 11, 262 (1878). Outro Link. Seu isômero de posição orto, havia sido preparado dois anos antes, pelo Químico Alemão Albert Ladenburg. LADENBURG, A. Ber. Dtsch. Chem. Gessel. , 9, 1524 (1876).
Ele foi introduzido em Terapêutica, em 1887, publicado em 1893, como sucedâneo da Fenacetina. Pelo Médico Alemão Josef Von Mering. VON MERING, I. Therap. Monastch. 7, 577 (1893) [artigo não encontrado, mas citado por, TREUPEL, G. DMW-Deutsche Medizinische Wochenschrift (1895)]. REFAT, M.S. Et Al. Arabian. J. Chem. 10, Supp.2, S2376 (2017).
Veja também: BRUNE, K.; RENNER, B.; TIEGS, G. Eur. J. Pain 19, 953 (2014). HAAS, H. Am. J. Med. 75, 1 (1983) .
O Paracetamol voltou a ser substituído pela Fenacetina, veja vários links, FERRARI, A. (2007), mas foi reintroduzido e voltou a ser usado como antipirético após 1948. Quando se confirmou que ele é o metabólito ativo da acetanilida e da fenacetina. BRODIE, B.B.; AXELROD, J. J. Phamacol. Exp. Therap. 94, 29 (1948). SMITH, J.N.; WILLIAMS, N.T. Biochem. J. 44, 242 (1949). Revisão: PRESCOTT, L.F. Am. J. Therap.7, 143 (2000). CLISSOLD, S.P. Drugs, 32, 46 (1986).
O Paracetamol foi consolidado no mercado pela Sterling-Winthrop Co, em 1953. DOMINGOS, H. (Aluna); GARRETT, R. (Orientador), “Química Nova Interativa.” BAPTISTELLA, L.H.B.; GIACOMINI, R.A.; IMAMURA, P.M. Quím. Nova 26, 284 (2003).
Atualmente, junto com a Aspirina, o Paracetamol é talvez, o medicamento mais usado no mundo. Principalmente em formulação de antigripais. SHARMA, C.V.; MEHTA, V. Continuing Education in Anaesthesia Critical Care & Pain, 14, 153 (2014). RUSSO, N.W.; PETRUCCI, G.; ROCCA, B. Vascular Pharmacology, 87, 14 (2016).
Com isso, vimos a História dos principais e mais usuais analgésicos, antipiréticos e antinflamatórios, cuja estrutura química é baseada nos salicilatos
4. DIPIRONA E FÁRMACOS RELACIONANDOS. ANALGÉSICOS PIRAZOLÔNICOS.
4A. Pirazolônicos Antigos:
Vimos acima, a História dos analgésicos salicilatos, do grupo da aspirina e relacionados.
Vamos então, ver a História de outro tipo de analgésicos, os pirazolônicos. São derivados do anel de Pirazol, com importância farmacêutica. JAMWAL, O. Et Al. J. Pharm. Biosci.3, 114 (2013). KHAN, M.F. Et Al. Eur. J. Med. Chem. 120, 170 (2016).
Ao nível de meu conhecimento, os primeiros derivados contendo o anel heterocíclico relacionado ao Pirazol, foram as “Pirazinas” e “Pirazóis” sintetizados no fim do século XIX, nos laboratórios dos famosos Químicos Alemâes Victor Meyer e Ludwig Knorr.
Referências, da descoberta: MASON, T. J. Chem. Soc. Trans. 55, 97 (1889). KNORR. L. J. Liebig Ann. Chem. 137 (1887). GUTKNECHT, H.; MEYER, V. (Laboratório de) Ber. Dtsch. Chem. Gessel. 12, 2290 (1889). WIDMAN, O. J. Prakt. Chem. 38, 185 (1888). KNORR, L.; LAUBMANN, H. Ber. Dtsch. Chem. Gessel. 22, 172 (1889). KNORR, L. Ber. Dtsch. Chem. Gessel. 16, 2597 (1883).
Experimental: WILEY, R.H.; HEXNER, P.E; JOHNSON, W.S.; HIGHET, R.J. Org. Syn. 31, 43 (1951)
Revisões: LI, J.J “Knorr Pyrazole Synthesis.” Name Reactions: A Collection of Detailed Reaction Mechanisms,331 (2006). SCHRECKER, L Et Al. React. Chem. Eng. 8, 41 (2023). FUSTERO, R. Et Al. Chem. Rev. 111, 6984 (2011). Pyrazole, Wikipedia.

O mesmo Químico Alemão, Ludwig Knorr, preparou a dimetil pirazolona e os fármacos antigos do tipo pirazolônico: Antipirina, Aminoantipirina (aminopirina ou Piramidon) e Aminofenazona, entre 1882-1886. KNORR, L.; Ber. Dtsch. Chem. Gessel. 17, 546 (1884). KNORR, L.; GEUTHER, T. J. Liebig. Ann. Chem. 293 , 55 (1896). ELLATAR, K.M.; FADDA, A.A. Synth. Comm. Rev. 46, 1567 (2015).


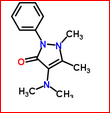
No mesmo ano, a Antipirina foi testada como analgésico, pelo Médico e Farmacologista Alemão Wilhelm Filehne. Veja as referências dele. E como antipirético, por Ferdinand May. Baixar PDF do Livro de May.
Esses fármacos pirazolônicos antigos foram muito usados nos séculos XIX e XX. Fabricados em larga escala. BNGEL, J. (1891). Exemplo, o Veramon, da Schering continha aminopirina e ainda existia no Brasil e outros países, até os anos 60, Outro link, indicado para dor de cabeça e neuralgia do trigêmio. FEDERMAN, A.D.D.; MONTI, D.D., Meus Pais, Médicos, comunicação pessoal (1971).
Mas foram sendo abandonados pouco a pouco, por poderem causar agranulocitose e leucopenia. VALE, N. “Desmistificando o Uso da Dipirona.”
O Piramidon era importado da Alemanha e muito usado no Brasil, na década de 20. BARROS, F.; WEBER, R.A; BARBOSA, R. Arch Rio-Grande Med. (1923). Mas cheguei a ver em farmácias antigas, nos anos 60. De fato, era ainda usado até os anos 50. BRODIE, B.B.; AXELROD, J. J. Pharmacol Exp. Therap. 99, 171 (1950).
4B. Dipirona:
O sucessor dessas antipirinas antigas é um pirazolônico extremamente conhecido a Dipirona ou Metamizol, um dos analgésicos e anti-inflamatórios mais usados no Brasil e no Mundo. BENSENOR, I.M. São Paulo Med. J. 119 (2001).
Mas pode haver certo risco de agranulocitose, se usada por tempo prolongado. HALFELD, G. Rev. Scienc. Farm.14, 9 (1992).
A Dipirona é um derivado sulfo conjugado (com grupo de ácido sulfônico) da aminopirina:

Ela foi feita através de pesquisas de modificação da antipirina e da aminopirina, feitas por Químicos Alemães da Hoechst, entre 1920 e 1922. NIKOLOVA, I., Et Al. Biotech & Biotech Equip. 26, 3329 (2012). MAIER, C. Acute Pain 2, 165 (1999).
Metamizol ou Dipirona. Ela foi patenteada, como sal de magnésio (Novalgin, Magnopyrol) em 1922, pela Hoechst junto com a Bayer , depois incluidas dentro de um conglomerado de empresas químicas que incluiu também a AGFA, BASF, Griesheim-Elektron e Vorm, conglomerado chamado I. G. Farbenindustrie AG.
Patente Original da Dipirona: Dentro de uma família de fármacos pirazolônicos, com grupos de enxofre. BOSKMUEHL,M.; SCHWARTZ, A. Patente Alemã DE476663C (1922-1929). FISCHER, J.; GANELLIN, C.R. “Analogue-Based Drug Discovery.” Editora John Wiley, New York, EUA, Pág. 530 (2006).
5 – ALGUMAS REAÇÕES DE IDENTIFICAÇÃO:
Sou Químico, por isso proponho algumas reações de identificação simples, que você pode usar para identificar alguns desses analgésicos, de maneira fácil.
Por exemplo, os pirazóis e pirazolonas, como a Dipirona, formam complexos sólidos com o ácido pícrico, um precipitante. SING, U.P. Et Al. Supramol. Chem. 24, 285 (2012). Outro Link. Também o Paracetamol. NWANISOBI, G. Arch. Pharm. Pharmacol. Res. 1, 1 (2018).

